正在加载图片...
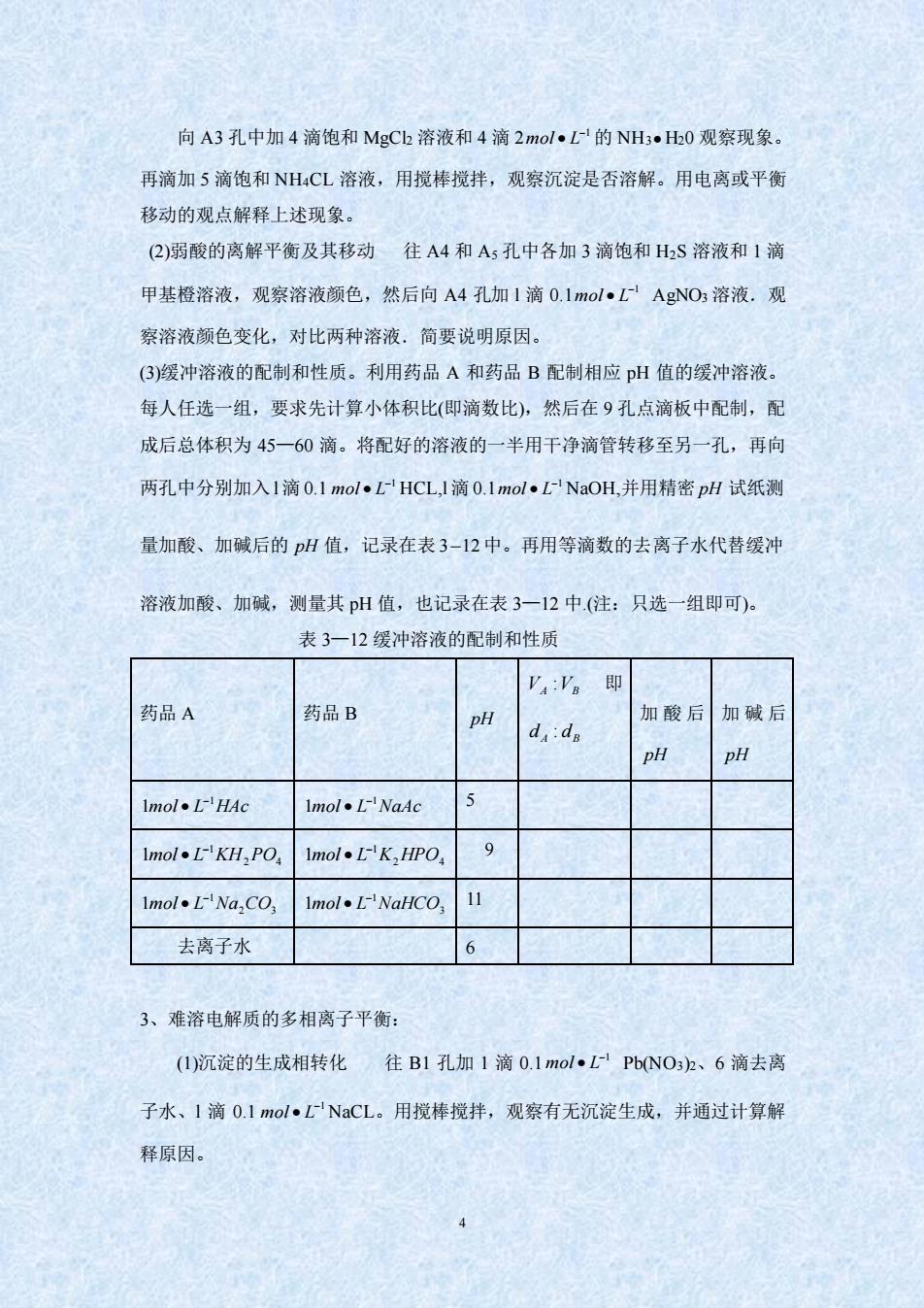
向A3孔中加4滴饱和MgCh溶液和4滴2molL的NH3·H0观察现象 再滴加5滴饱和NH4CL溶液,用搅棒搅拌,观察沉淀是否溶解。用电离或平衡 移动的观点解释上述现象。 2)弱酸的离解平衡及其移动往A4和A孔中各加3滴饱和HS溶液和1滴 甲基橙溶液,观察溶液颜色,然后向A4孔加1滴0.1mol·L AgNO3溶液.观 察溶液颜色变化,对比两种溶液。简要说明原因。 (3)缓冲溶液的配制和性质。利用药品A和药品B配制相应pH值的缓冲溶液。 每人任选一组,要求先计算小体积比(即滴数比),然后在9孔点滴板中配制,配 成后总体积为45一60滴。将配好的溶液的一半用干净滴管转移至另一孔,再向 两孔中分别加入1滴0.1mol,LHCL,l滴0.1mol,L-NaOH,并用精密pH试纸测 量加酸、加碱后的H值,记录在表3-12中。再用等滴数的去离子水代替缓冲 溶液加酸、加碱,测量其pH值,也记录在表3一12中(注:只选一组即可) 表3一12缓冲溶液的配制和性质 药品A 药品B pH 加酸后加碱后 d:dn pH pH Imol.LHAc lmol·L-NaAc lmol·LKH2PO Imol.LK,HPO 9 mol.LNa.CO. mol.LNaHCO 去离子水 6 3、难溶电解质的多相离子平衡: ()沉淀的生成相转化往B1孔加1滴0.1mo1 L-Pb(NO32、6滴去离 子水、1滴0.Imol·LNaCL。用搅棒搅拌,观察有无沉淀生成,并通过计算解 释原因。4 向 A3 孔中加 4 滴饱和 MgCl2 溶液和 4 滴 2 −1 mol • L 的 NH3 • H20 观察现象。 再滴加 5 滴饱和 NH4CL 溶液,用搅棒搅拌,观察沉淀是否溶解。用电离或平衡 移动的观点解释上述现象。 (2)弱酸的离解平衡及其移动 往 A4 和 A5 孔中各加 3 滴饱和 H2S 溶液和 1 滴 甲基橙溶液,观察溶液颜色,然后向 A4 孔加 l 滴 0.1 −1 mol • L AgNO3 溶液.观 察溶液颜色变化,对比两种溶液.简要说明原因。 (3)缓冲溶液的配制和性质。利用药品 A 和药品 B 配制相应 pH 值的缓冲溶液。 每人任选一组,要求先计算小体积比(即滴数比),然后在 9 孔点滴板中配制,配 成后总体积为 45—60 滴。将配好的溶液的一半用干净滴管转移至另一孔,再向 两孔中分别加入 l滴 0.1 −1 mol • L HCL,l 滴 0.1 −1 mol • L NaOH,并用精密 pH 试纸测 量加酸、加碱后的 pH 值,记录在表 3 12 中。再用等滴数的去离子水代替缓冲 溶液加酸、加碱,测量其 pH 值,也记录在表 3—12 中.(注:只选一组即可)。 表 3—12 缓冲溶液的配制和性质 药品 A 药品 B pH VA VB : 即 d A dB : 加酸后 pH 加碱后 pH mol L HAc 1 1 − • mol L NaAc 1 1 − • 5 2 4 1 1mol L KH PO − • 2 4 1 1mol L K HPO − • 9 2 3 1 1mol L Na CO − • 3 1 1mol L NaHCO − • 11 去离子水 6 3、难溶电解质的多相离子平衡: (1)沉淀的生成相转化 往 B1 孔加 1 滴 0.1 −1 mol • L Pb(NO3)2、6 滴去离 子水、l 滴 0.1 −1 mol • L NaCL。用搅棒搅拌,观察有无沉淀生成,并通过计算解 释原因