正在加载图片...
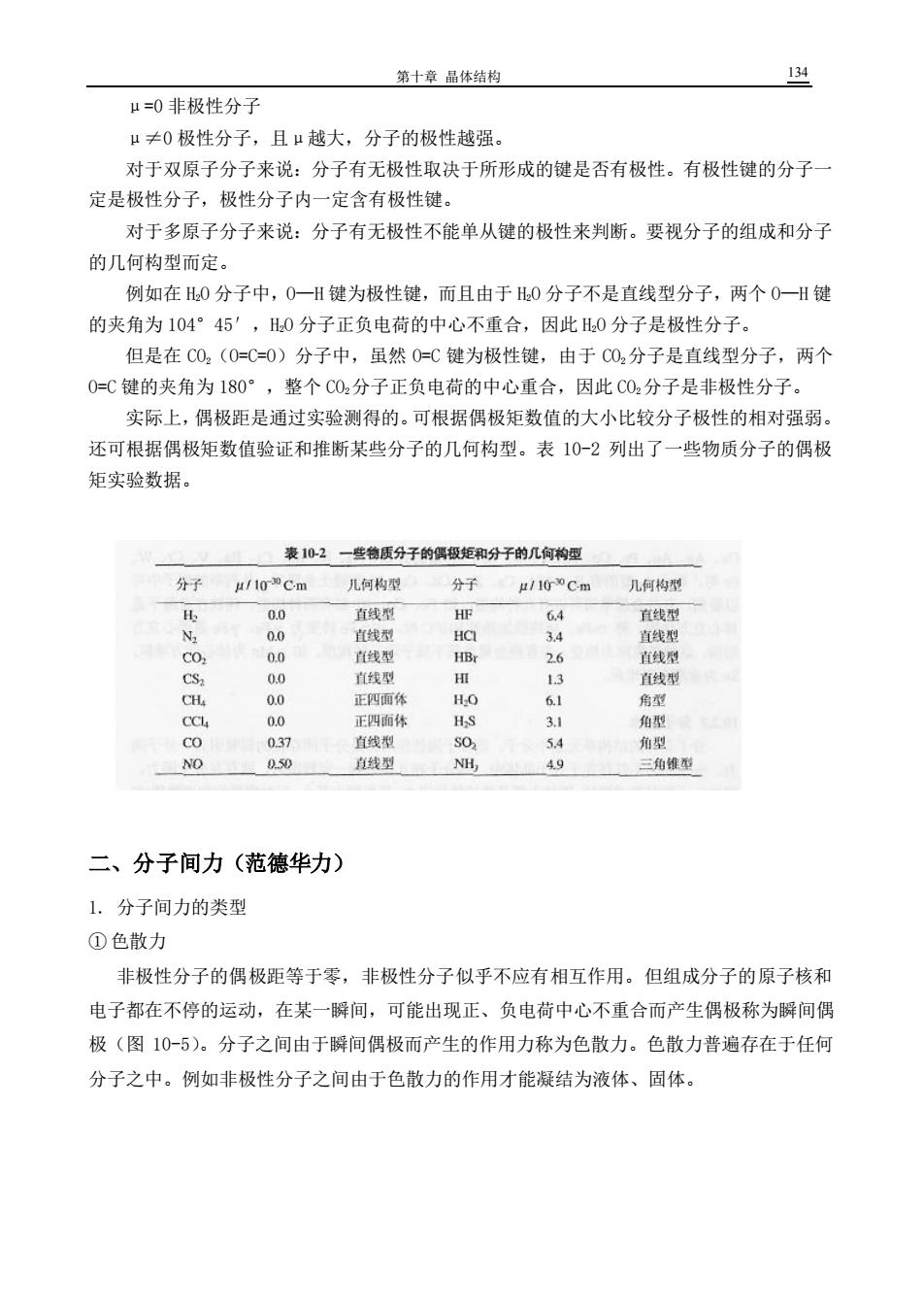
第十章品体结构 134 μ=0非极性分子 μ≠0极性分子,且μ越大,分子的极性越强 对于双原子分子来说:分子有无极性取决于所形成的键是否有极性。有极性键的分子 定是极性分子,极性分子内一定含有极性键。 对于多原子分子来说:分子有无极性不能单从键的极性来判断。要视分子的组成和分子 的几何构型而定。 例如在0分子中,0一H键为极性键,而且由于0分子不是直线型分子,两个0一H键 的夹角为104°45',H0分子正负电荷的中心不重合,因此0分子是极性分子。 但是在C0,(0=C=0)分子中,虽然0=C键为极性键,由于C02分子是直线型分子,两个 0=C键的夹角为180°,整个C02分子正负电荷的中心重合,因此C02分子是非极性分子。 实际上,偶极距是通过实验测得的。可根据偶极矩数值的大小比较分子极性的相对强弱。 还可根据偶极矩数值验证和推断某些分子的几何构型。表10-2列出了一些物质分子的偶极 矩实验数据。 表102一些物质分子的偶极矩和分子的几何构厘 分子 μ/10Cm 儿何构型 分子 几何构型 00 直线型 HE 64 直线型 00 宜直线型 4 直线型 CO. 0.0 直线型 H 26 直生侧 直线型 直线型 正四面体 HO 6 角的 正四面体 角形 037 直线型 30 54 角生 NO 050 线型 NH, 49 三角维型 二、分子间力(范德华力) 1.分子间力的类型 ①色散力 非极性分子的偶极距等于零,非极性分子似乎不应有相互作用。但组成分子的原子核和 电子都在不停的运动,在某一解间,可能出现正、负电荷中心不重合而产生偶极称为瞬间偶 极(图10-5)。分子之间由于瞬间偶极而产生的作用力称为色散力。色散力普遍存在于任何 分子之中。例如非极性分子之间由于色散力的作用才能凝结为液体、固体。 第十章 晶体结构 134 μ=0 非极性分子 μ≠0 极性分子,且μ越大,分子的极性越强。 对于双原子分子来说:分子有无极性取决于所形成的键是否有极性。有极性键的分子一 定是极性分子,极性分子内一定含有极性键。 对于多原子分子来说:分子有无极性不能单从键的极性来判断。要视分子的组成和分子 的几何构型而定。 例如在 H2O 分子中,O—H 键为极性键,而且由于 H2O 分子不是直线型分子,两个 O—H 键 的夹角为 104°45′,H2O 分子正负电荷的中心不重合,因此 H2O 分子是极性分子。 但是在 CO2(O=C=O)分子中,虽然 O=C 键为极性键,由于 CO2分子是直线型分子,两个 O=C 键的夹角为 180°,整个 CO2分子正负电荷的中心重合,因此 CO2分子是非极性分子。 实际上,偶极距是通过实验测得的。可根据偶极矩数值的大小比较分子极性的相对强弱。 还可根据偶极矩数值验证和推断某些分子的几何构型。表 10-2 列出了一些物质分子的偶极 矩实验数据。 二、分子间力(范德华力) 1. 分子间力的类型 ① 色散力 非极性分子的偶极距等于零,非极性分子似乎不应有相互作用。但组成分子的原子核和 电子都在不停的运动,在某一瞬间,可能出现正、负电荷中心不重合而产生偶极称为瞬间偶 极(图 10-5)。分子之间由于瞬间偶极而产生的作用力称为色散力。色散力普遍存在于任何 分子之中。例如非极性分子之间由于色散力的作用才能凝结为液体、固体