正在加载图片...
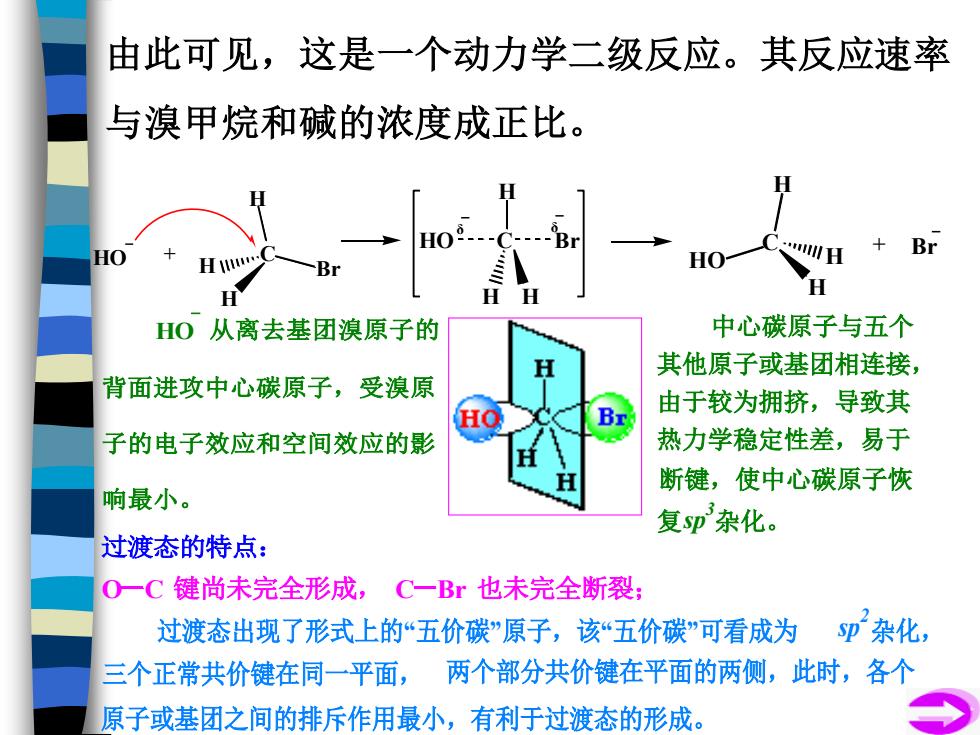
由此可见,这是一个动力学二级反应。其反应速率 与溴甲烷和碱的浓度成正比。 Br HO H HO H H0从离去基团溴原子的 中心碳原子与五个 H 其他原子或基团相连接, 背面进攻中心碳原子,受溴原 由于较为拥挤,导致其 Br 子的电子效应和空间效应的影 热力学稳定性差,易于 断键,使中心碳原子恢 响最小。 复sp杂化。 过渡态的特点: OC键尚未完全形成, C一Br也未完全断裂; 过渡态出现了形式上的“五价碳”原子,该“五价碳”可看成为 p杂化, 三个正常共价键在同一平面,两个部分共价键在平面的两侧,此时,各个 原子或基团之间的排斥作用最小,有利于过渡态的形成。 由此可见,这是一个动力学二级反应。其反应速率 与溴甲烷和碱的浓度成正比。 HO + C H H H Br HO C Br H H H δ δ C HO H H H + Br HO 从离去基团溴原子的 背面进攻中心碳原子,受溴原 子的电子效应和空间效应的影 响最小。 过渡态的特点: O C 键尚未完全形成, C Br 也未完全断裂; 三个正常共价键在同一平面, 两个部分共价键在平面的两侧,此时,各个 原子或基团之间的排斥作用最小,有利于过渡态的形成。 过渡态出现了形式上的“五价碳”原子,该“五价碳”可看成为 sp 2 杂化, 复sp 3 中心碳原子与五个 其他原子或基团相连接, 由于较为拥挤,导致其 热力学稳定性差,易于 断键,使中心碳原子恢 杂化