正在加载图片...
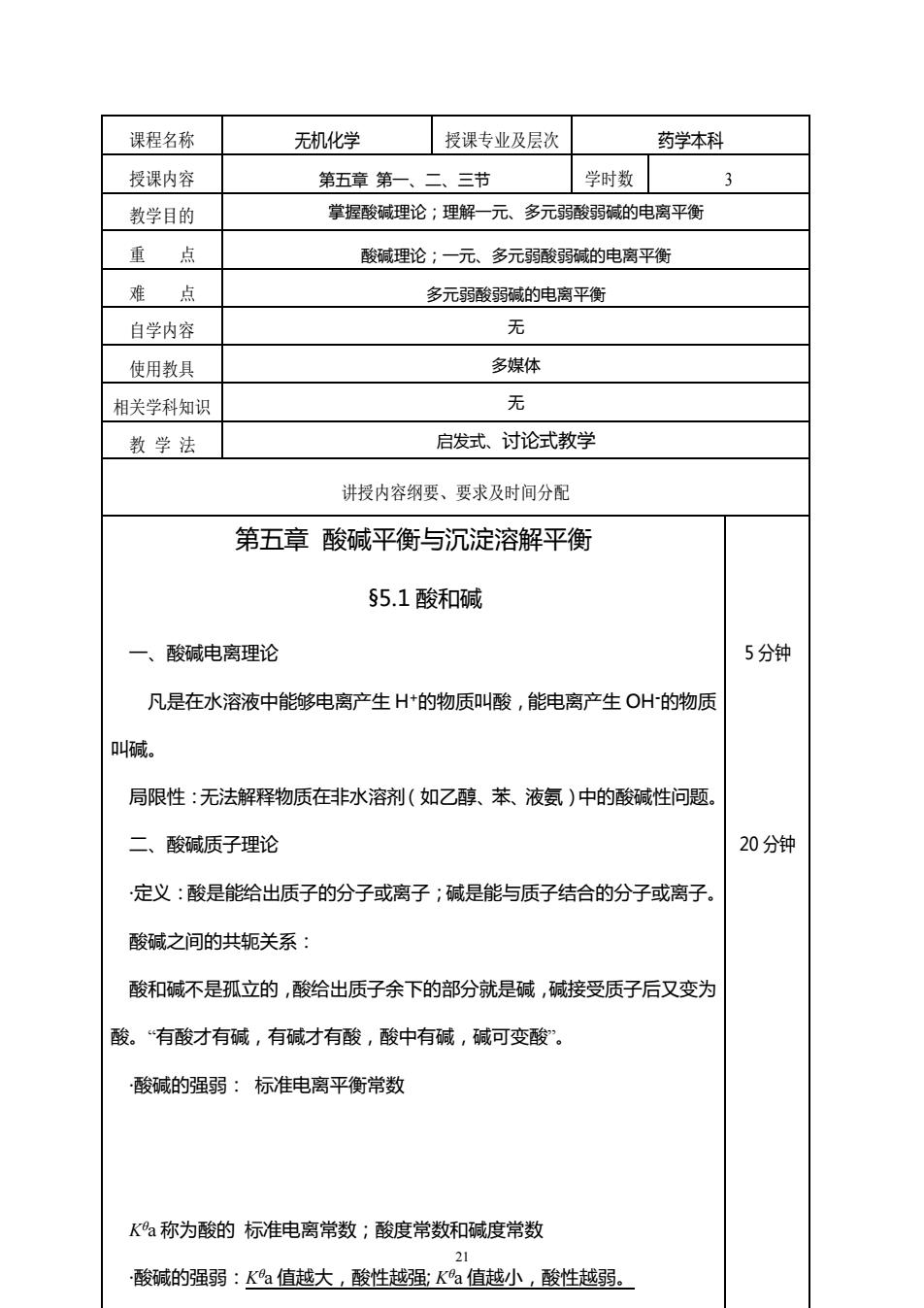
课程名称 无机化学 授课专业及层次 药学本科 授课内容 第五章第一、二、三节 学时数 3 教学目的 掌握酸碱理论;理解一元、多元弱酸弱碱的电离平衡 重点 酸碱理论;一元、多元弱酸弱碱的电离平衡 难点 多元弱酸弱碱的电离平衡 自学内容 无 使用教具 多媒体 相关学科知识 无 教学法 启发式、讨论式教学 讲授内容纲要、要求及时间分配 第五章酸碱平衡与沉淀溶解平衡 55.1酸和碱 一、酸碱电离理论 5分钟 凡是在水溶液中能够电离产生H+的物质叫酸,能电离产生OH的物质 叫碱。 局限性:无法解释物质在非水溶剂(如乙醇、苯、液氨)中的酸碱性问题。 二、酸碱质子理论 20分钟 定义:酸是能给出质子的分子或离子;碱是能与质子结合的分子或离子 酸碱之间的共轭关系: 酸和碱不是孤立的,酸给出质子余下的部分就是碱,碱接受质子后又变为 酸。“有酸才有碱,有碱才有酸,酸中有碱,碱可变酸。 酸碱的强弱:标准电离平衡常数 称为酸的标准电离常数;酸度常数和碱度常数 酸碱的强弱:K值越大,酸性越强:K值越小,酸性越弱。 21 课程名称 无机化学 授课专业及层次 药学本科 授课内容 第五章 第一、二、三节 学时数 3 教学目的 掌握酸碱理论;理解一元、多元弱酸弱碱的电离平衡 重 点 酸碱理论;一元、多元弱酸弱碱的电离平衡 难 点 多元弱酸弱碱的电离平衡 自学内容 无 使用教具 多媒体 相关学科知识 无 教 学 法 启发式、讨论式教学 讲授内容纲要、要求及时间分配 第五章 酸碱平衡与沉淀溶解平衡 §5.1 酸和碱 一、酸碱电离理论 凡是在水溶液中能够电离产生 H+的物质叫酸,能电离产生 OH-的物质 叫碱。 局限性:无法解释物质在非水溶剂(如乙醇、苯、液氨)中的酸碱性问题。 二、酸碱质子理论 ·定义:酸是能给出质子的分子或离子;碱是能与质子结合的分子或离子。 酸碱之间的共轭关系: 酸和碱不是孤立的,酸给出质子余下的部分就是碱,碱接受质子后又变为 酸。“有酸才有碱,有碱才有酸,酸中有碱,碱可变酸”。 ·酸碱的强弱: 标准电离平衡常数 Kθa 称为酸的 标准电离常数;酸度常数和碱度常数 ·酸碱的强弱:Kθa 值越大,酸性越强; Kθa 值越小,酸性越弱。 5 分钟 20 分钟