正在加载图片...
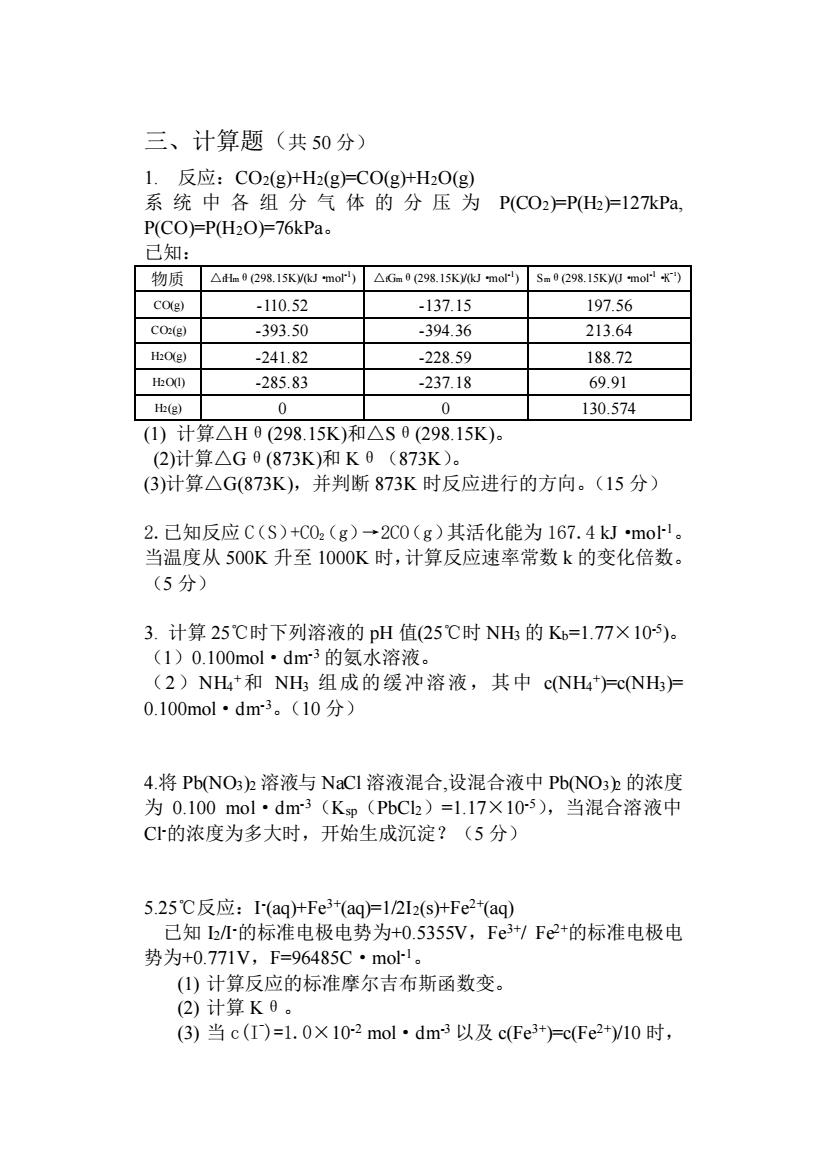
三、计算题(共50分) 1.反应:CO2(g+H2(g)=CO(g十HO(g) 系统中各组分气体的分压为PC02广P)=127kPa P(CO)=P(H2O)=76kPa 已知: 物质△h0298.15 Ky(kJ mor△Gm0298.15 Ky(kJmo)50298.15K0mor) CO(g) -110.52 -137.15 197.56 CO(g) -393.50 -394.36 213.64 H:O(e) -241.82 .22859 188.72 O -285.83 -237.18 69.91 H(g) 0 0 130.574 (1)计算△H0(298.15K)和△S0(298.15K)。 (2)计算△G0(873K)和K0(873K)。 (3)计算△G(873K),并判断873K时反应进行的方向。(15分) 2.已知反应C(S)+C02(g)→2C0(g)其活化能为167.4 kJ.mol-1。 当温度从500K升至1000K时,计算反应速率常数k的变化倍数。 (5分) 3.计算25℃时下列溶液的pH值(25℃时NH的K=1.77×10). (1)0.100mol·dm3的氨水溶液。 (2)NH和NH组成的缓冲溶液,其中cNH=cNH= 0.100mol·dm3。(10分) 4.将PbNO3h溶液与NaCI溶液混合,设混合液中PbNO3h的浓度 为0.100mol·dm3(Kp(PbCh)=1.17×105),当混合溶液中 C的浓度为多大时,开始生成沉淀?(5分) 5.25℃反应:I(aq)+Fe3+(aqFl2I2(stFe2+(aq) 己知b/M的标准电极电势为+0.5355V,Fe3/Fe2+的标准电极电 势为+0.771V,F=96485C·mol。 (I)计算反应的标准摩尔吉布斯函数变 (2)计算K6。 (3)当c(T)=l.0×102mol·dm3以及c(Fe3=c(Fe2+)10时,三、计算题(共 50 分) 1. 反应:CO2(g)+H2(g)=CO(g)+H2O(g) 系统中各组分气体的分压为 P(CO2)=P(H2)=127kPa, P(CO)=P(H2O)=76kPa。 已知: 物质 △fHmθ(298.15K)/(kJ·mol-1 ) △fGmθ(298.15K)/(kJ·mol-1 ) Smθ(298.15K)/(J·mol-1·K -1 ) CO(g) -110.52 -137.15 197.56 CO2(g) -393.50 -394.36 213.64 H2O(g) -241.82 -228.59 188.72 H2O(l) -285.83 -237.18 69.91 H2(g) 0 0 130.574 (1) 计算△Hθ(298.15K)和△Sθ(298.15K)。 (2)计算△Gθ(873K)和 Kθ(873K)。 (3)计算△G(873K),并判断 873K 时反应进行的方向。(15 分) 2.已知反应 C(S)+CO2(g)→2CO(g)其活化能为 167.4 kJ·mol-1。 当温度从 500K 升至 1000K 时,计算反应速率常数 k 的变化倍数。 (5 分) 3. 计算 25℃时下列溶液的 pH 值(25℃时 NH3 的 Kb=1.77×10-5 )。 (1)0.100mol·dm-3 的氨水溶液。 (2)NH4 +和 NH3 组成的缓冲溶液,其中 c(NH4 + )=c(NH3)= 0.100mol·dm-3。(10 分) 4.将 Pb(NO3)2 溶液与 NaCl 溶液混合,设混合液中 Pb(NO3)2 的浓度 为 0.100 mol·dm-3(Ksp(PbCl2)=1.17×10-5),当混合溶液中 Cl-的浓度为多大时,开始生成沉淀?(5 分) 5.25℃反应:I - (aq)+Fe3+(aq)=1/2I2(s)+Fe2+(aq) 已知 I2/I-的标准电极电势为+0.5355V,Fe3+/ Fe2+的标准电极电 势为+0.771V,F=96485C·mol-1。 (1) 计算反应的标准摩尔吉布斯函数变。 (2) 计算 Kθ。 (3) 当 c(I- )=1.0×10-2 mol·dm-3 以及 c(Fe3+)=c(Fe2+)/10 时