正在加载图片...
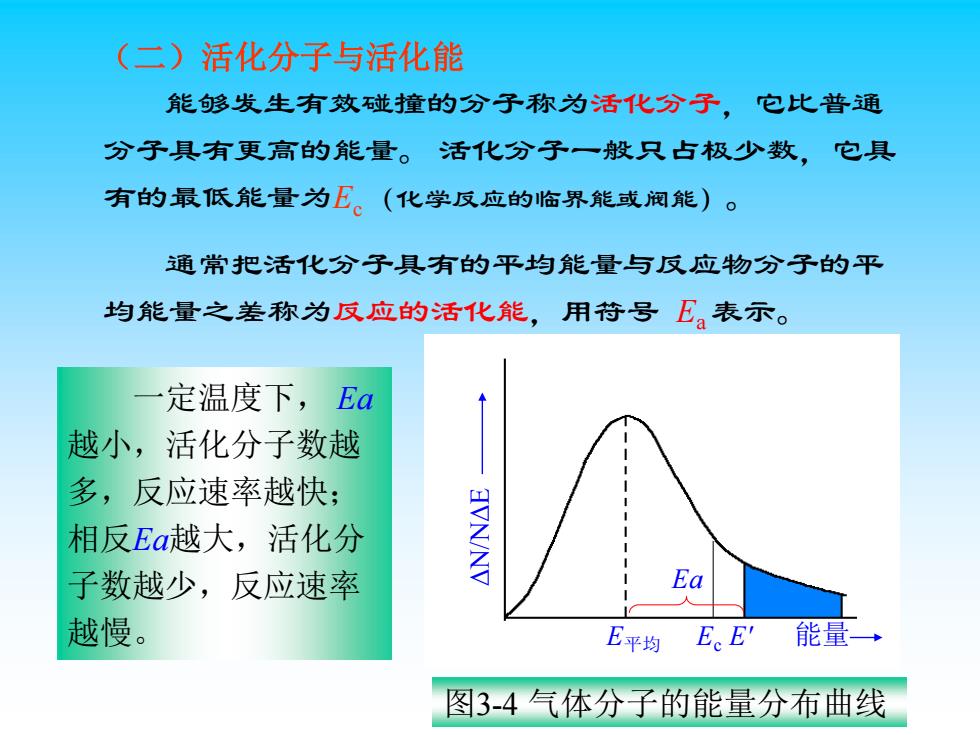
(二)活化分子与活化能 能够发生有效碰撞的分子称为活化分子,它比普通 分子具有更高的能量。活化分子一般只占极少数,它具 有的最低能量为E。(化学反应的临界能或阀能)。 通常把活化分子具有的平均能量与反应物分子的平 均能量之差称为反应的活化能,用苻号E。表示。 定温度下,Ea 越小,活化分子数越 多,反应速率越快; 相反Ea越大,活化分 子数越少,反应速率 Ea 越慢。 E平均 E。E'能量→ 图3-4气体分子的能量分布曲线 能够发生有效碰撞的分子称为活化分子,它比普通 分子具有更高的能量。 活化分子一般只占极少数,它具 有的最低能量为Ec (化学反应的临界能或阀能)。 通常把活化分子具有的平均能量与反应物分子的平 均能量之差称为反应的活化能,用符号 Ea 表示。 (二)活化分子与活化能 Ea E平均 E' 能量 图3-4 气体分子的能量分布曲线 一定温度下, Ea 越小,活化分子数越 多,反应速率越快; 相反Ea越大,活化分 子数越少,反应速率 越慢。 Ec