正在加载图片...
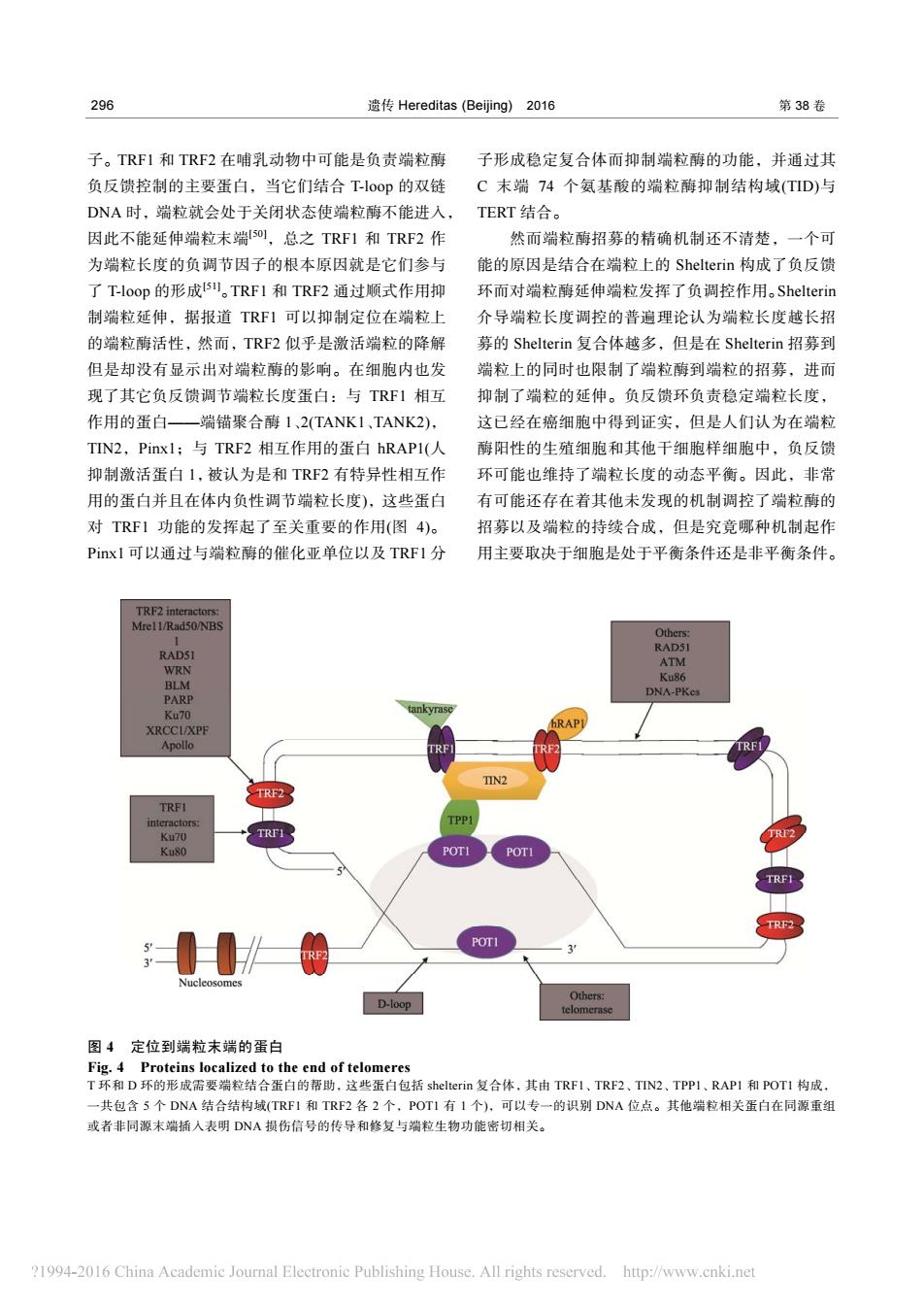
296 遗传Hereditas(Beijing)2016 第38卷 子。TRFI和TRF2在哺乳动物中可能是负责端粒酶 子形成稳定复合体而抑制端粒酶的功能,并通过其 负反馈控制的主要蛋白,当它们结合T-loop的双链 C末端74个氨基酸的端粒酶抑制结构域(TID)与 DNA时,端粒就会处于关闭状态使端粒酶不能进入,TERT结合。 因此不能延伸端粒末端5OI,总之TRF1和TRF2作 然而端粒酶招募的精确机制还不清楚,一个可 为端粒长度的负调节因子的根本原因就是它们参与 能的原因是结合在端粒上的Shelterin构成了负反馈 了T-loop的形成5。TRF1和TRF2通过顺式作用抑 环而对端粒酶延伸端粒发挥了负调控作用。Shelterin 制端粒延伸,据报道TRF1可以抑制定位在端粒上 介导端粒长度调控的普遍理论认为端粒长度越长招 的端粒酶活性,然而,TRF2似乎是激活端粒的降解 募的Shelterin复合体越多,但是在Shelterin招募到 但是却没有显示出对端粒酶的影响。在细胞内也发 端粒上的同时也限制了端粒酶到端粒的招募,进而 现了其它负反馈调节端粒长度蛋白:与TRF1相互 抑制了端粒的延伸。负反馈环负责稳定端粒长度, 作用的蛋白一端锚聚合酶1、2(TANK1、TANK2), 这已经在癌细胞中得到证实,但是人们认为在端粒 TIN2,Pinxl;与TRF2相互作用的蛋白hRAPI(人 酶阳性的生殖细胞和其他干细胞样细胞中,负反馈 抑制激活蛋白1,被认为是和TRF2有特异性相互作 环可能也维持了端粒长度的动态平衡。因此,非常 用的蛋白并且在体内负性调节端粒长度),这些蛋白 有可能还存在着其他未发现的机制调控了端粒酶的 对TRF1功能的发挥起了至关重要的作用(图4)。 招募以及端粒的持续合成,但是究竟哪种机制起作 Pix1可以通过与端粒酶的催化亚单位以及TRF1分 用主要取决于细胞是处于平衡条件还是非平衡条件。 TRF2 interactors: Mrel1/Rad50/NBS Others: RAD5I RADS1 ATM WRN Ku86 BLM DNA-PKes PARP Ku70 tankyrase XRCCI/XPF hRAP Apollo TRF TRFI TIN2 TRF2 TRFI interactors: TPPI Ku70 Ku80 POTI POTI TRF1 TRF2 POTI 3 Nucleosomes D-loop Others: telomerase 图4定位到端粒末端的蛋白 Fig.4 Proteins localized to the end of telomeres T环和D环的形成需要揣粒结合蛋白的帮助,这些蛋白包括shelterin复合体,其由TRF1、TRF2、TIN2、TPPI、RAPI和POT1构成, 一共包含5个DNA结合结构域(TRF1和TRF2各2个,POT1有1个),可以专一的识别DNA位点。其他端粒相关蛋白在同源重组 或者非同源末端插入表明DNA损伤信号的传导和修复与端粒生物功能密切相关。 ?1994-2016 China Academic Journal Electronic Publishing House.All rights reserved.http://www.cnki.net296 遗传 Hereditas (Beijing) 2016 第 38 卷 子。TRF1 和 TRF2 在哺乳动物中可能是负责端粒酶 负反馈控制的主要蛋白,当它们结合 T-loop 的双链 DNA 时,端粒就会处于关闭状态使端粒酶不能进入, 因此不能延伸端粒末端[50],总之 TRF1 和 TRF2 作 为端粒长度的负调节因子的根本原因就是它们参与 了 T-loop 的形成[51]。TRF1 和 TRF2 通过顺式作用抑 制端粒延伸,据报道 TRF1 可以抑制定位在端粒上 的端粒酶活性,然而,TRF2 似乎是激活端粒的降解 但是却没有显示出对端粒酶的影响。在细胞内也发 现了其它负反馈调节端粒长度蛋白:与 TRF1 相互 作用的蛋白——端锚聚合酶 1、2(TANK1、TANK2), TIN2,Pinx1;与 TRF2 相互作用的蛋白 hRAP1(人 抑制激活蛋白 1,被认为是和 TRF2 有特异性相互作 用的蛋白并且在体内负性调节端粒长度),这些蛋白 对 TRF1 功能的发挥起了至关重要的作用(图 4)。 Pinx1 可以通过与端粒酶的催化亚单位以及 TRF1 分 子形成稳定复合体而抑制端粒酶的功能,并通过其 C 末端 74 个氨基酸的端粒酶抑制结构域(TID)与 TERT 结合。 然而端粒酶招募的精确机制还不清楚,一个可 能的原因是结合在端粒上的 Shelterin 构成了负反馈 环而对端粒酶延伸端粒发挥了负调控作用。Shelterin 介导端粒长度调控的普遍理论认为端粒长度越长招 募的 Shelterin 复合体越多,但是在 Shelterin 招募到 端粒上的同时也限制了端粒酶到端粒的招募,进而 抑制了端粒的延伸。负反馈环负责稳定端粒长度, 这已经在癌细胞中得到证实,但是人们认为在端粒 酶阳性的生殖细胞和其他干细胞样细胞中,负反馈 环可能也维持了端粒长度的动态平衡。因此,非常 有可能还存在着其他未发现的机制调控了端粒酶的 招募以及端粒的持续合成,但是究竟哪种机制起作 用主要取决于细胞是处于平衡条件还是非平衡条件。 图 4 定位到端粒末端的蛋白 Fig. 4 Proteins localized to the end of telomeres T 环和 D 环的形成需要端粒结合蛋白的帮助,这些蛋白包括 shelterin 复合体,其由 TRF1、TRF2、TIN2、TPP1、RAP1 和 POT1 构成, 一共包含 5 个 DNA 结合结构域(TRF1 和 TRF2 各 2 个,POT1 有 1 个),可以专一的识别 DNA 位点。其他端粒相关蛋白在同源重组 或者非同源末端插入表明 DNA 损伤信号的传导和修复与端粒生物功能密切相关