正在加载图片...
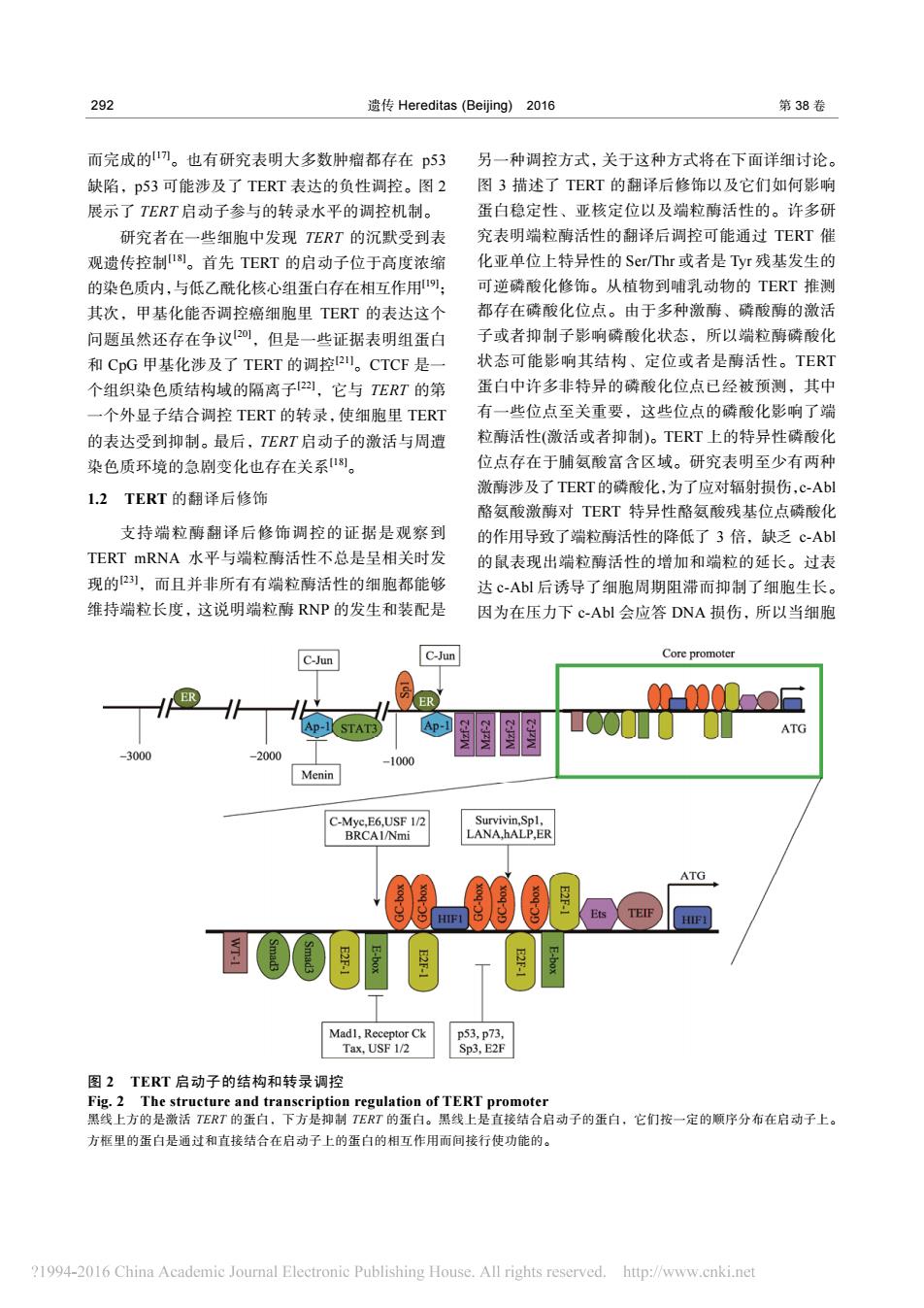
292 遗传Hereditas(Beijing)2016 第38卷 而完成的。也有研究表明大多数肿瘤都存在p53 另一种调控方式,关于这种方式将在下面详细讨论。 缺陷,p53可能涉及了TERT表达的负性调控。图2 图3描述了TERT的翻译后修饰以及它们如何影响 展示了TERT启动子参与的转录水平的调控机制。 蛋白稳定性、亚核定位以及端粒酶活性的。许多研 研究者在一些细胞中发现TERT的沉默受到表 究表明端粒酶活性的翻译后调控可能通过TERT催 观遗传控制8。首先TERT的启动子位于高度浓缩 化亚单位上特异性的Ser/Thr或者是Tyr残基发生的 的染色质内,与低乙酰化核心组蛋白存在相互作用: 可逆磷酸化修饰。从植物到哺乳动物的TERT推测 其次,甲基化能否调控癌细胞里TERT的表达这个 都存在磷酸化位点。由于多种激酶、磷酸酶的激活 问题虽然还存在争议20,但是一些证据表明组蛋白 子或者抑制子影响磷酸化状态,所以端粒酶磷酸化 和CpG甲基化涉及了TERT的调控2。CTCF是一 状态可能影响其结构、定位或者是酶活性。TERT 个组织染色质结构域的隔离子22,它与TERT的第 蛋白中许多非特异的磷酸化位点已经被预测,其中 一个外显子结合调控TERT的转录,使细胞里TERT 有一些位点至关重要,这些位点的磷酸化影响了端 的表达受到抑制。最后,TERT启动子的激活与周遭 粒酶活性(激活或者抑制)。TERT上的特异性磷酸化 染色质环境的急剧变化也存在关系。 位点存在于脯氨酸富含区域。研究表明至少有两种 激酶涉及了TERT的磷酸化,为了应对辐射损伤,c-Abl 1.2TERT的翻译后修饰 酪氨酸激酶对TERT特异性酪氨酸残基位点磷酸化 支持端粒酶翻译后修饰调控的证据是观察到 的作用导致了端粒酶活性的降低了3倍,缺乏c-Ab1 TERT mRNA水平与端粒酶活性不总是呈相关时发 的鼠表现出端粒酶活性的增加和端粒的延长。过表 现的2),而且并非所有有端粒酶活性的细胞都能够 达c-Abl后诱导了细胞周期阻滞而抑制了细胞生长。 维持端粒长度,这说明端粒酶RNP的发生和装配是 因为在压力下c-Abl会应答DNA损伤,所以当细胞 C-Jun C-Jun Core promoter 人ER Ap-1 STAT. AP- ATG -3000 2000 -1000 Menin C-Mye,E6,USF 1/2 Survivin,Spl, BRCAI/Nmi LANA,hALP,ER ATG 0=008 TEIF Mad1,Receptor Ck p53,p73, Tax,USF 1/2 Sp3,E2F 图2TERT启动子的结构和转录调控 Fig.2 The structure and transcription regulation of TERT promoter 黑线上方的是激活TERT的蛋白,下方是抑制TERT的蛋白。黑线上是直接结合启动子的蛋白,它们按一定的顺序分布在启动子上。 方框里的蛋白是通过和直接结合在启动子上的蛋白的相互作用而间接行使功能的。 ?1994-2016 China Academic Journal Electronic Publishing House.All rights reserved.http://www.cnki.net292 遗传 Hereditas (Beijing) 2016 第 38 卷 而完成的[17]。也有研究表明大多数肿瘤都存在 p53 缺陷,p53 可能涉及了 TERT 表达的负性调控。图 2 展示了 TERT 启动子参与的转录水平的调控机制。 研究者在一些细胞中发现 TERT 的沉默受到表 观遗传控制[18]。首先 TERT 的启动子位于高度浓缩 的染色质内,与低乙酰化核心组蛋白存在相互作用[19]; 其次,甲基化能否调控癌细胞里 TERT 的表达这个 问题虽然还存在争议[20],但是一些证据表明组蛋白 和 CpG 甲基化涉及了 TERT 的调控[21]。CTCF 是一 个组织染色质结构域的隔离子[22],它与 TERT 的第 一个外显子结合调控 TERT 的转录,使细胞里 TERT 的表达受到抑制。最后,TERT 启动子的激活与周遭 染色质环境的急剧变化也存在关系[18]。 1.2 TERT 的翻译后修饰 支持端粒酶翻译后修饰调控的证据是观察到 TERT mRNA 水平与端粒酶活性不总是呈相关时发 现的[23],而且并非所有有端粒酶活性的细胞都能够 维持端粒长度,这说明端粒酶 RNP 的发生和装配是 另一种调控方式,关于这种方式将在下面详细讨论。 图 3 描述了 TERT 的翻译后修饰以及它们如何影响 蛋白稳定性、亚核定位以及端粒酶活性的。许多研 究表明端粒酶活性的翻译后调控可能通过 TERT 催 化亚单位上特异性的 Ser/Thr 或者是 Tyr 残基发生的 可逆磷酸化修饰。从植物到哺乳动物的 TERT 推测 都存在磷酸化位点。由于多种激酶、磷酸酶的激活 子或者抑制子影响磷酸化状态,所以端粒酶磷酸化 状态可能影响其结构、定位或者是酶活性。TERT 蛋白中许多非特异的磷酸化位点已经被预测,其中 有一些位点至关重要,这些位点的磷酸化影响了端 粒酶活性(激活或者抑制)。TERT 上的特异性磷酸化 位点存在于脯氨酸富含区域。研究表明至少有两种 激酶涉及了TERT的磷酸化,为了应对辐射损伤,c-Abl 酪氨酸激酶对 TERT 特异性酪氨酸残基位点磷酸化 的作用导致了端粒酶活性的降低了 3 倍,缺乏 c-Abl 的鼠表现出端粒酶活性的增加和端粒的延长。过表 达 c-Abl 后诱导了细胞周期阻滞而抑制了细胞生长。 因为在压力下 c-Abl 会应答 DNA 损伤,所以当细胞 图 2 TERT 启动子的结构和转录调控 Fig. 2 The structure and transcription regulation of TERT promoter 黑线上方的是激活 TERT 的蛋白,下方是抑制 TERT 的蛋白。黑线上是直接结合启动子的蛋白,它们按一定的顺序分布在启动子上。 方框里的蛋白是通过和直接结合在启动子上的蛋白的相互作用而间接行使功能的