正在加载图片...
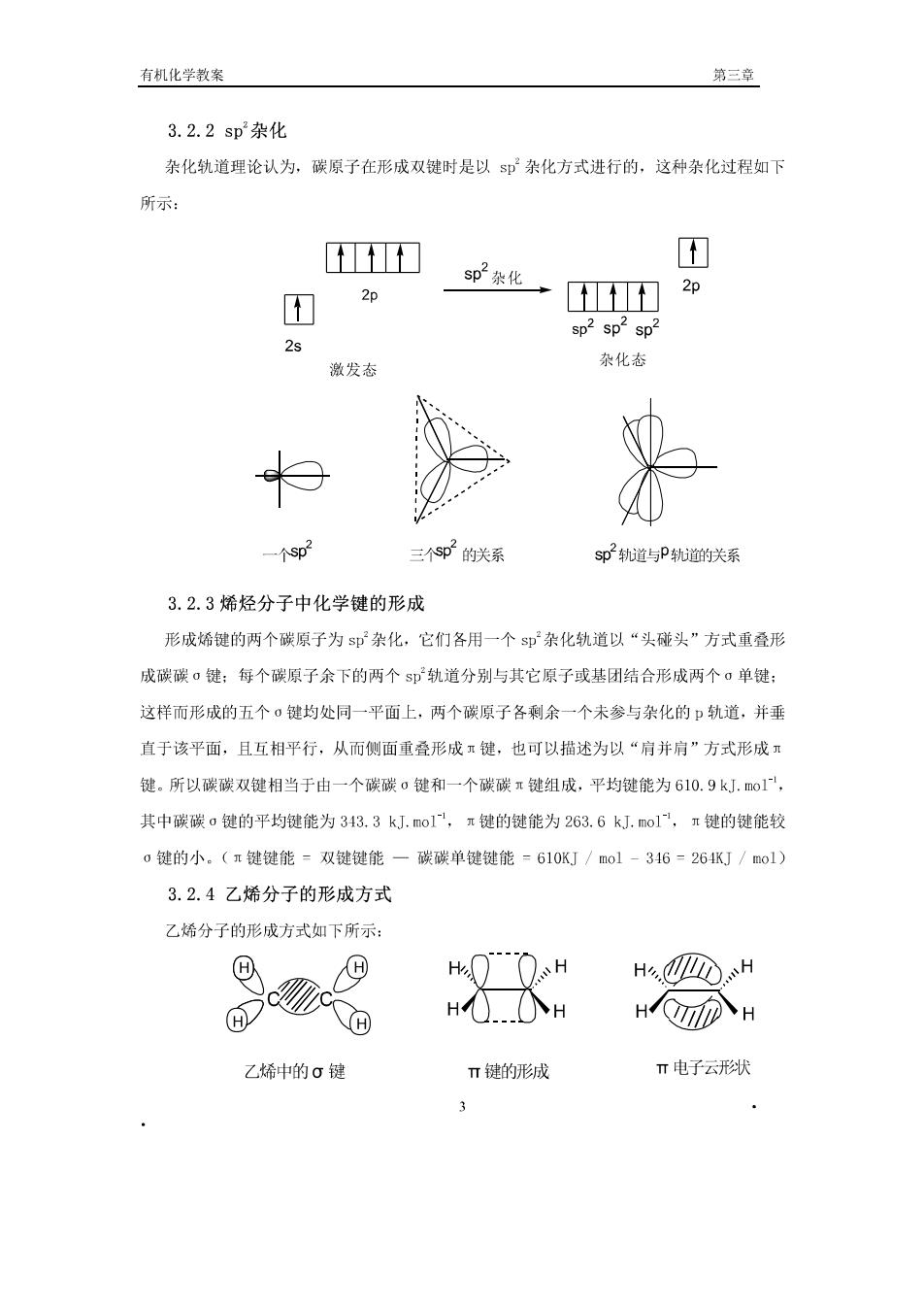
有机化学教案 第三章】 3.2.2sp杂化 杂化轨道理论认为,碳原子在形成双键时是以s即杂化方式进行的,这种杂化过程如下 所示 D T 团 2p p款化,] 2p sp2sp2 sp2 2s 激发态 杂化态 个sp2 三个02的关系 sp2轨道与P轨道的关系 3.2.3烯烃分子中化学键的形成 形成烯键的两个碳原子为即杂化,它们各用一个s即杂化轨道以“头碰头”方式重叠形 成碳碳。键:每个碳原子余下的两个$即轨道分别与其它原子或基团结合形成两个▣单键: 这样而形成的五个·键均处同一平面上,两个碳原子各剩余一个未参与杂化的口轨道,并垂 直于该平面,且互相平行,从而侧面重叠形成键,也可以捐述为以“肩并肩”方式形成 键。所以碳碳双键相当于由一个碳碳o键和一个碳碳π键组成,平均键能为610.9kJ.o1。 其中碳碳o键的平均键能为343.3kJ.o1,π键的键能为263.6k.mo1,π键的键能较 o键的小.(π键键能-双键键能一碳碳单键键能-610KJ/ol-346-26KJ/o1) 3.2.4乙烯分子的形成方式 乙烯分子的形成方式如下所示: HH Hi.OH HIOTIIDH 乙烯的σ键 T键的形成 π电子云形状 3