正在加载图片...
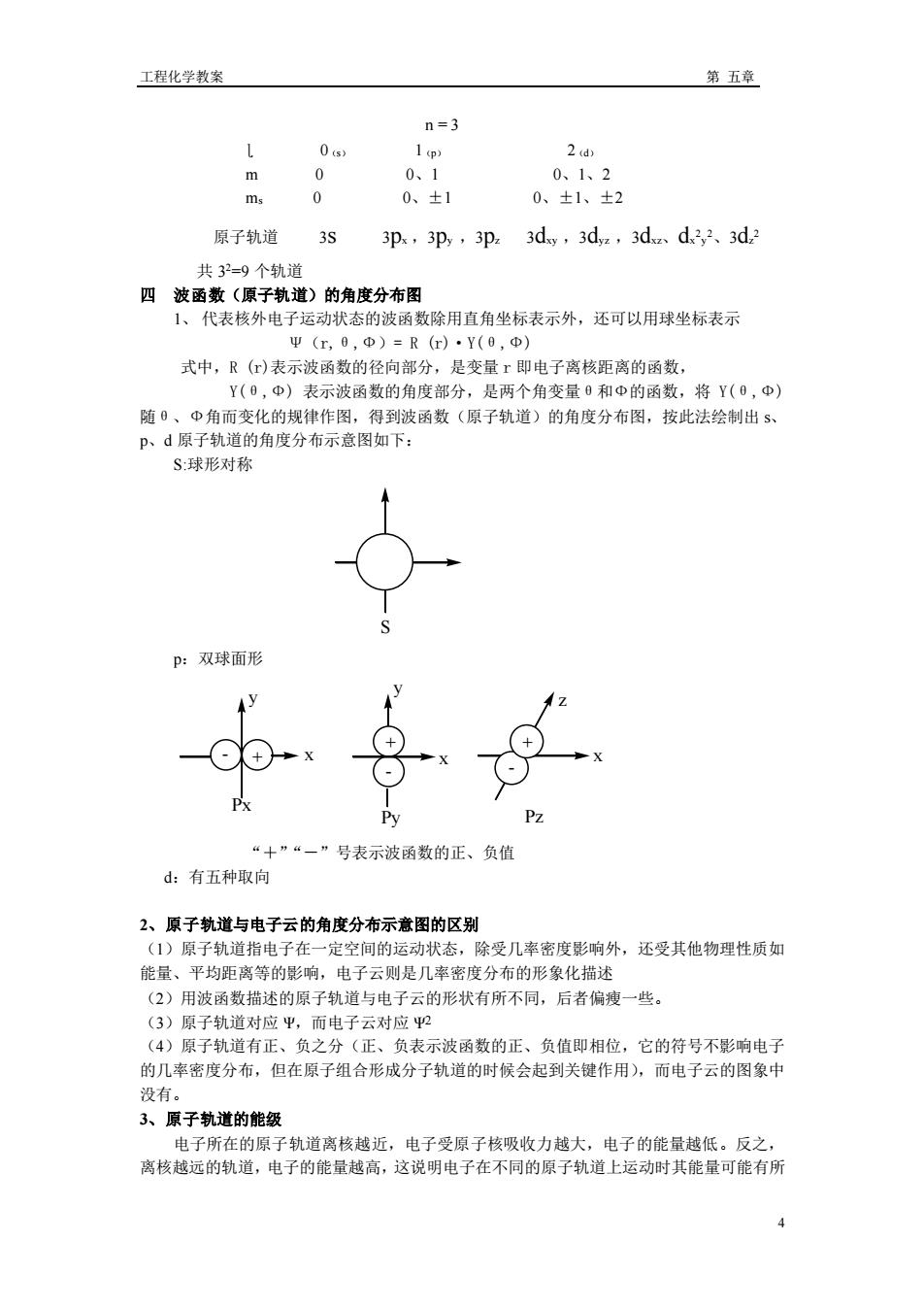
工程化学教案 第五章 n=3 1 2 d) m 、 0、1、2 ms 0 0、±1 0、±1、±2 原子轨道 3S 3p,3p,3p 3dy,3d.,3d、d3,2、3d 共3=9个轨道 四波函数(原子轨道)的角度分布图 1、代表核外电子运动状态的波函数除用直角坐标表示外,还可以用球坐标表示 Ψ(m,8,Φ)=R(r)·Y(8,Φ) 式中,R()表示波函数的径向部分,是变量r即电子离核距离的函数, Y(0,中)表示波函数的角度部分,是两个角变量0和中的函数,将Y(0,中) 随、Φ角而变化的规律作图,得到波函数(原子轨道)的角度分布图,按此法绘制出5 P、d原子轨道的角度分布示意图如下 S:球形对称 p:双球面形 ”“一”号表示波函数的正、负值 d:有五种取向 2、原子轨道与电子云的角度分布示意图的区别 1)原 子轨道指电子在 一定空间的运动状态 除受几率密度影响外,还受其他物理性质如 能量、平均距离等的影响,电子云则是几率密度分布的形象化描述 (2)用波函数描述的原子轨道与电子云的形状有所不同,后者偏瘦一些。 (3)原子轨道对应甲,而电子云对应2 (4)原子轨道有正、负之分(正、负表示波函数的正、负值即相位,它的符号不影响电子 的几率密度分布,但在原子组合形成分子轨道的时候会起到关键作用),而电子云的图象中 没有 3、原子轨道的能级 电子所在的原子轨道离核越近,电子受原子核吸收力越大,电子的能量越低。反之, 离核越远的轨道,电子的能量越高,这说明电子在不同的原子轨道上运动时其能量可能有所 4工程化学教案 第 五章 4 n = 3 ɭ 0(s) 1(p) 2(d) m 0 0、1 0、1、2 ms 0 0、±1 0、±1、±2 原子轨道 3s 3px ,3py ,3pz 3dxy ,3dyz ,3dxz、dx 2 y 2、3dz 2 共 3 2=9 个轨道 四 波函数(原子轨道)的角度分布图 1、 代表核外电子运动状态的波函数除用直角坐标表示外,还可以用球坐标表示 Ψ(r,θ,Ф)= R (r)·Y(θ,Ф) 式中,R (r)表示波函数的径向部分,是变量 r 即电子离核距离的函数, Y(θ,Ф) 表示波函数的角度部分,是两个角变量θ和Ф的函数,将 Y(θ,Ф) 随θ、Ф角而变化的规律作图,得到波函数(原子轨道)的角度分布图,按此法绘制出 s、 p、d 原子轨道的角度分布示意图如下: S:球形对称 S p:双球面形 - + + - + - + - Px Py Pz x y z x y x “+”“-”号表示波函数的正、负值 d:有五种取向 2、原子轨道与电子云的角度分布示意图的区别 (1)原子轨道指电子在一定空间的运动状态,除受几率密度影响外,还受其他物理性质如 能量、平均距离等的影响,电子云则是几率密度分布的形象化描述 (2)用波函数描述的原子轨道与电子云的形状有所不同,后者偏瘦一些。 (3)原子轨道对应 Ψ,而电子云对应 Ψ2 (4)原子轨道有正、负之分(正、负表示波函数的正、负值即相位,它的符号不影响电子 的几率密度分布,但在原子组合形成分子轨道的时候会起到关键作用),而电子云的图象中 没有。 3、原子轨道的能级 电子所在的原子轨道离核越近,电子受原子核吸收力越大,电子的能量越低。反之, 离核越远的轨道,电子的能量越高,这说明电子在不同的原子轨道上运动时其能量可能有所