正在加载图片...
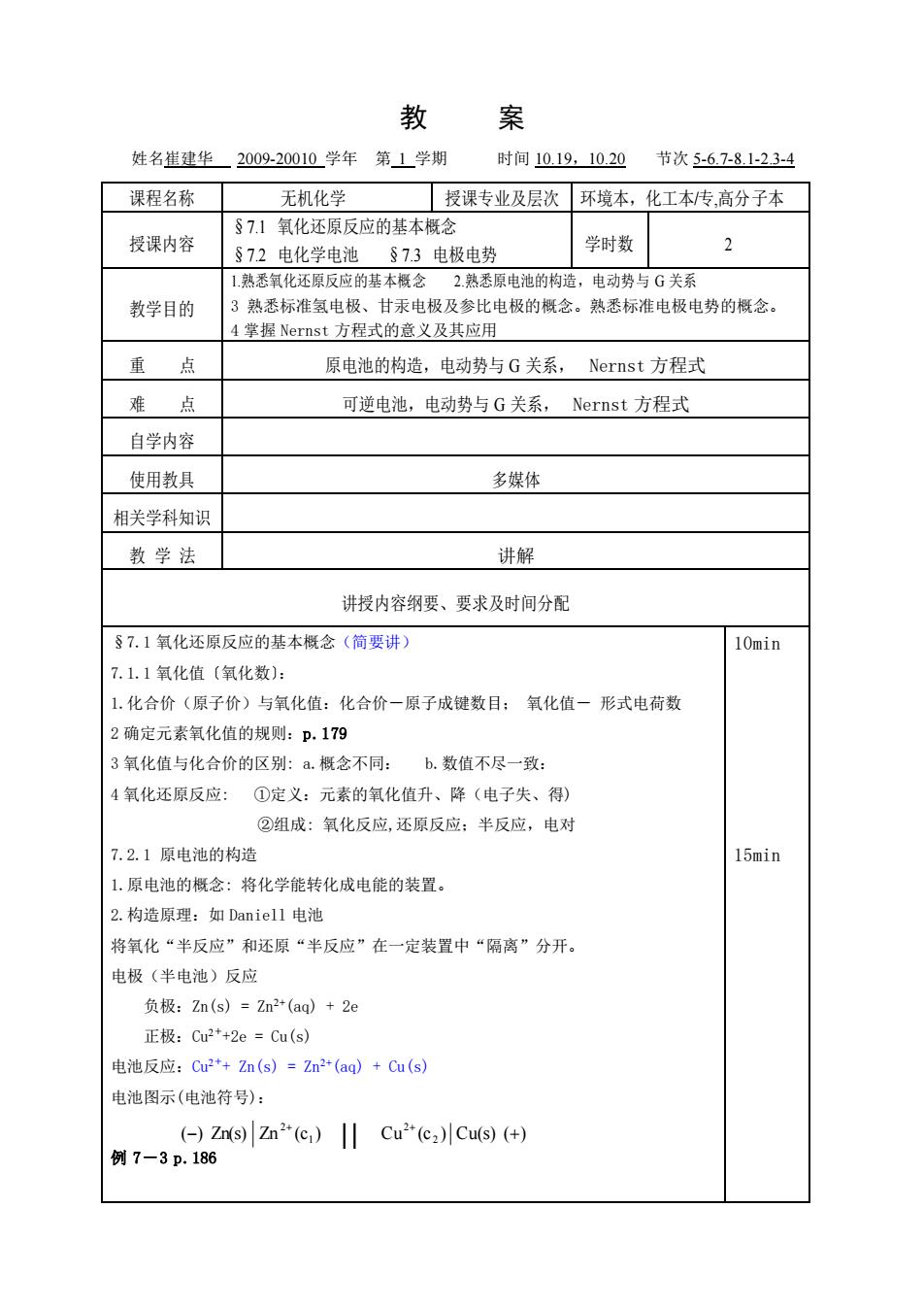
教 案 姓名崔建华2009-20010学年第1学期 时间1019,1020 节次5-67-8.1-23-4 课程名称 无机化学 授课专业及层次环境本,化工本传高分子本 §7.1氧化还原反应的基本概念 授课内容 §72电化学电池§73电极电势 学时数 2 1熟悉氧化还原反应的基本概念2熟悉原电池的构造,电动势与G关系 教学目的 3熟悉标准氢电极、甘汞电极及参比电极的概念。熟悉标准电极电势的概念 掌握Nernst方程式的意义及其应用 重点 原电池的构造,电动势与G关系,Nernst方程式 难点 可逆电池,电动势与G关系,Nernst方程式 自学内容 使用教具 多媒体 相关学科知识 教学法 讲解 讲授内容纲要、要求及时间分配 §7.1氧化还原反应的基本概念(简要讲) 10min 7.1.1氧化值(氧化数): 1.化合价(原子价)与氧化值:化合价一原子成键数目:氧化值一形式电荷数 2确定元素氧化值的规则:p.179 3氧化值与化合价的区别:a.概念不同:b.数值不尽一致: 4氧化还原反应:①定义:元素的氧化值升、降(电子失、得) ②组成:氧化反应,还原反应:半反应,电对 7.2.1原申池的构造 15min 1.原电池的概念:将化学能转化成电能的装置。 2.构造原理:如Daniell电池 将氧化“半反应”和还原“半反应”在一定装置中“隔离”分开。 电极(半电池)反应 负极:Zn(s)=Zn2(aq)+2e 正极:Cu2*+2e=Cu(s) 电池反应:C2*+Zn(s)=Zm2*(aq)+Cu(s) 电池图示(电池符号): ()Zn(s)Zn2(c)Cu"(c2)Cu(s)(+ 例7-3p.186教 案 姓名崔建华 2009-20010 学年 第 1 学期 时间 10.19,10.20 节次 5-6.7-8.1-2.3-4 课程名称 无机化学 授课专业及层次 环境本,化工本/专,高分子本 授课内容 §7.1 氧化还原反应的基本概念 §7.2 电化学电池 §7.3 电极电势 学时数 2 教学目的 1.熟悉氧化还原反应的基本概念 2.熟悉原电池的构造,电动势与 G 关系 3 熟悉标准氢电极、甘汞电极及参比电极的概念。熟悉标准电极电势的概念。 4 掌握 Nernst 方程式的意义及其应用 重 点 原电池的构造,电动势与 G 关系, Nernst 方程式 难 点 可逆电池,电动势与 G 关系, Nernst 方程式 自学内容 使用教具 多媒体 相关学科知识 教 学 法 讲解 讲授内容纲要、要求及时间分配 §7.1 氧化还原反应的基本概念(简要讲) 7.1.1 氧化值〔氧化数〕: 1.化合价(原子价)与氧化值:化合价-原子成键数目; 氧化值- 形式电荷数 2 确定元素氧化值的规则:p.179 3 氧化值与化合价的区别: a.概念不同: b.数值不尽一致: 4 氧化还原反应: ①定义:元素的氧化值升、降(电子失、得) ②组成: 氧化反应,还原反应;半反应,电对 7.2.1 原电池的构造 1.原电池的概念: 将化学能转化成电能的装置。 2.构造原理:如 Daniell 电池 将氧化“半反应”和还原“半反应”在一定装置中“隔离”分开。 电极(半电池)反应 负极:Zn(s) = Zn2+(aq) + 2e 正极:Cu2+ +2e = Cu(s) 电池反应:Cu2+ + Zn(s) = Zn2+(aq) + Cu(s) 电池图示(电池符号): 例 7-3 p.186 10min 15min ( ) Zn(s) Zn (c ) Cu (c ) Cu(s) ( ) 2 2 1 2 − + + + ‖