正在加载图片...
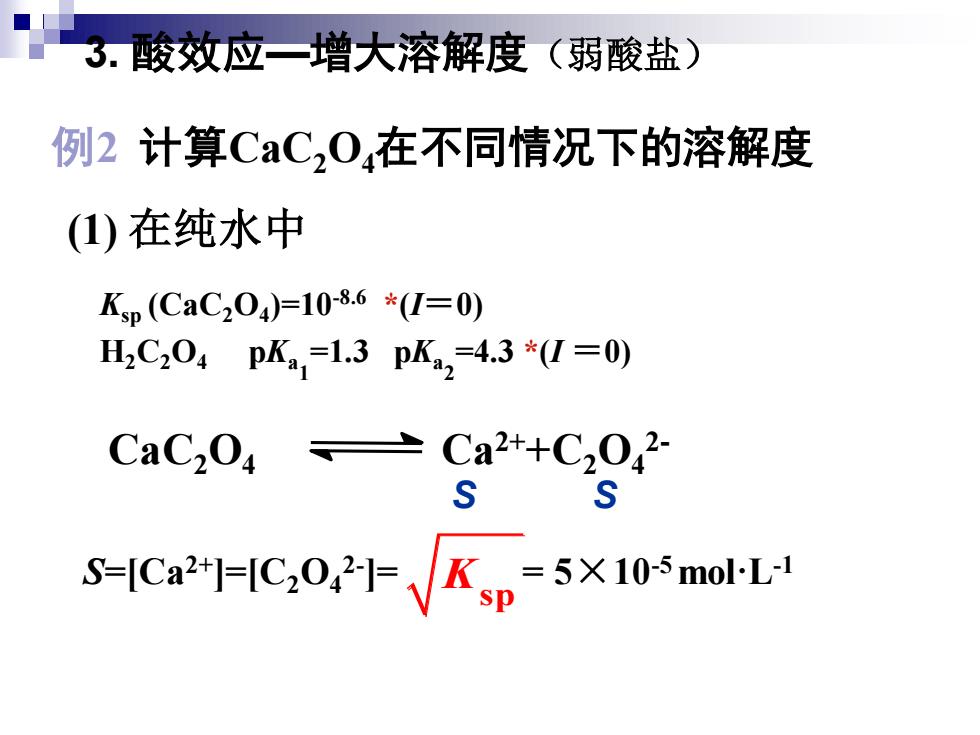
3.酸效应一增大溶解度(弱酸盐) 例2计算CaC,04在不同情况下的溶解度 (1)在纯水中 Ksp(CaC204)=10-8.6*(I=0) H2C204pK1=1.3pK2=4.3*(I=0) CaC204=Ca2+C2042 S-C-C:OKp-5X105mol-L 3. 酸效应—增大溶解度(弱酸盐) 例2 计算CaC2O4在不同情况下的溶解度 (1) 在纯水中 Ksp (CaC2O4 )=10-8.6 *(I=0) H2C2O4 pKa 1 =1.3 pKa 2 =4.3 *(I =0) CaC2O4 Ca2++C2O4 2- S S S=[Ca2+]=[C2O4 2- ]= = 5×10-5 mol·L-1 sp K