正在加载图片...
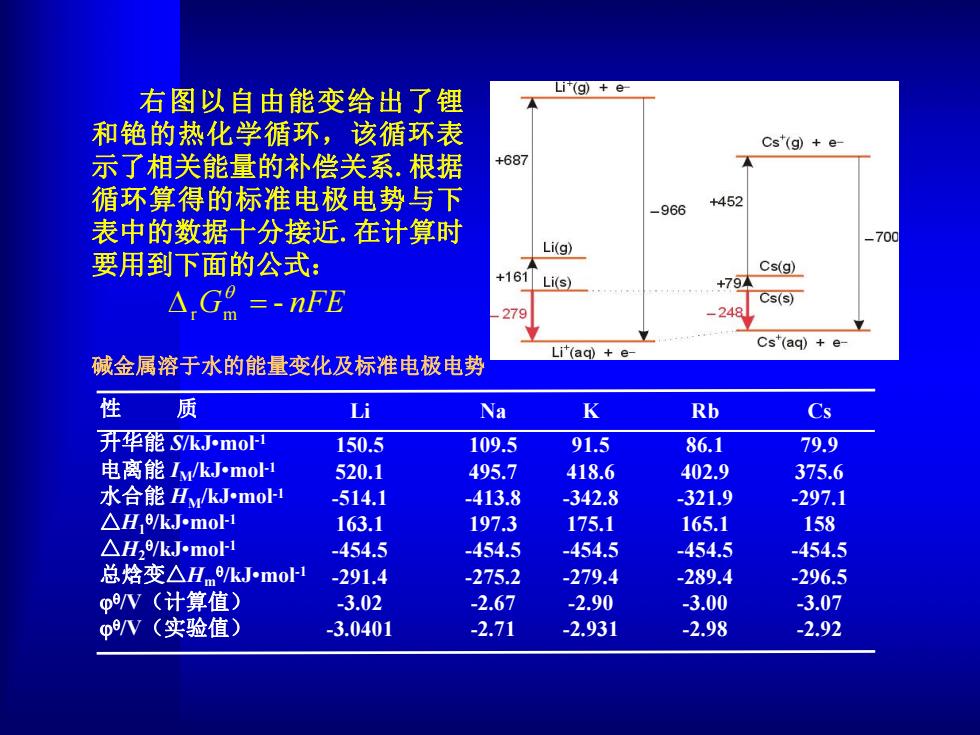
右图以自由能变给出了锂 (g)+e 和铯的热化学循环,该循环表 Cs"(g)e- 示了相关能量的补偿关系.根据 +687 循环算得的标准电极电势与下 +452 -966 表中的数据十分接近,在计算时 -700 Li(g) 要用到下面的公式: Cs(g) +161 Li(s) +79 △,Ga=nFE Cs(s) 279 Li(ag)e Cs"(aq)+e- 碱金属溶于水的能量变化及标准电极电势 性 质 Li Na K Rb Cs 升华能S/kJ-mol 150.5 109.5 91.5 86.1 79.9 电离能Iy/kJ-mol 520.1 495.7 418.6 402.9 375.6 水合能Hy/kJ.mol-1 -514.1 -413.8 -342.8 -321.9 -297.1 △He/kJ.mol- 163.1 197.3 175.1 165.1 158 △H2/kJ-mol- -454.5 -454.5 -454.5 -454.5 -454.5 总烙变△Hm0/kJ-mol1 -291.4 -275.2 -279.4 -289.4 -296.5 p/V(计算值) -3.02 -2.67 -2.90 -3.00 -3.07 φW(实验值) -3.0401 -2.71 -2.931 -2.98 -2.92右图以自由能变给出了锂 和铯的热化学循环,该循环表 示了相关能量的补偿关系.根据 循环算得的标准电极电势与下 表中的数据十分接近.在计算时 要用到下面的公式: DrGm - nFE q Na 109.5 495.7 -413.8 197.3 -454.5 -275.2 -2.67 -2.71 碱金属溶于水的能量变化及标准电极电势 性 质 升华能 S/kJ•mol -1 电离能 IM/kJ•mol -1 水合能 HM/kJ•mol -1 △H1q/kJ•mol -1 △H2q/kJ•mol -1 总焓变△Hm q/kJ•mol -1 q/V(计算值) q/V(实验值) Li 150.5 520.1 -514.1 163.1 -454.5 -291.4 -3.02 -3.0401 K 91.5 418.6 -342.8 175.1 -454.5 -279.4 -2.90 -2.931 Rb 86.1 402.9 -321.9 165.1 -454.5 -289.4 -3.00 -2.98 Cs 79.9 375.6 -297.1 158 -454.5 -296.5 -3.07 -2.92