正在加载图片...
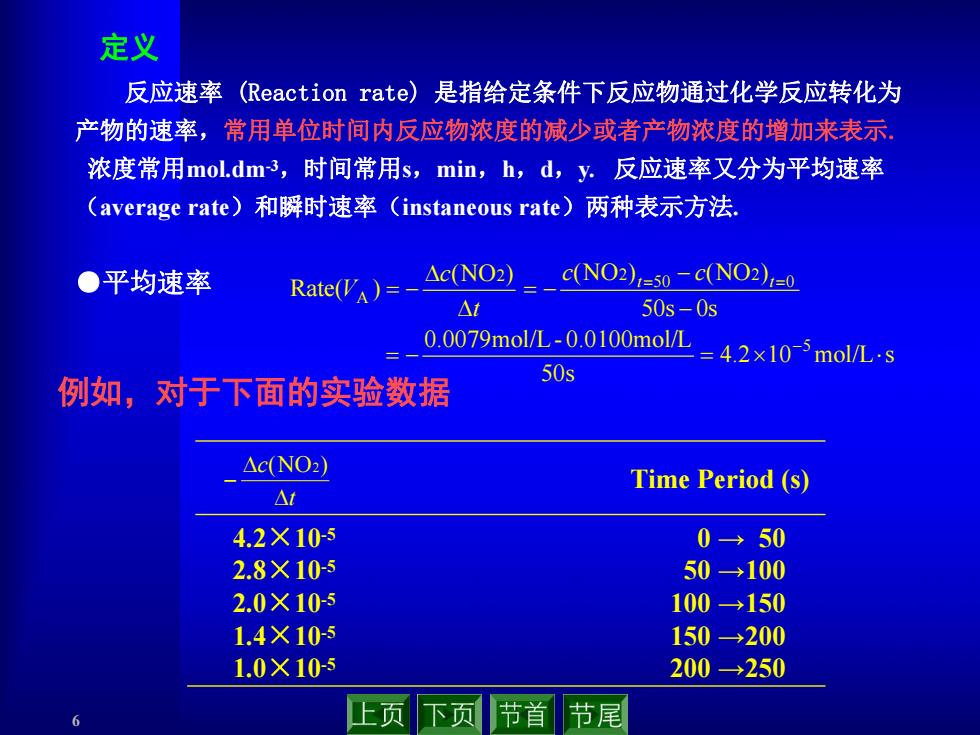
定义 反应速率 (Reaction rate))是指给定条件下反应物通过化学反应转化为 产物的速率,常用单位时间内反应物浓度的减少或者产物浓度的增加来表示, 浓度常用mol.dm3,时间常用s,min,h,d,y.反应速率又分为平均速率 (average rate)和瞬时速率(instaneous rate)两种表示方法, ●平均速率 Rate(VA)=- △cNO2 c(NO2)=50-c(NO2)=0 △t 50s-0s 0.0079molL-0.0100molL=42×10-5molL-s 50s 例如,对于下面的实验数据 △c(NO) Time Period (s) △7 4.2×105 0→50 2.8×10-5 50→100 2.0×105 100→150 1.4×10-s 150→200 1.0×10-5 200→250 上页下页 节首 节尾 6 反应速率 (Reaction rate) 是指给定条件下反应物通过化学反应转化为 产物的速率,常用单位时间内反应物浓度的减少或者产物浓度的增加来表示. 浓度常用mol.dm-3,时间常用s,min,h,d,y. 反应速率又分为平均速率 (average rate)和瞬时速率(instaneous rate)两种表示方法. 定义 4.2 10 mol/L s 50s 0.0079mol/L- 0.0100mol/L 50s 0s (NO ) (NO ) (NO ) Rate( ) 5 0 2 50 2 2 A t t c c t c V t c (NO2) Time Period (s) 4.2×10-5 2.8×10-5 2.0×10-5 1.4×10-5 1.0×10-5 0 → 50 50 →100 100 →150 150 →200 200 →250 ●平均速率 例如,对于下面的实验数据