正在加载图片...
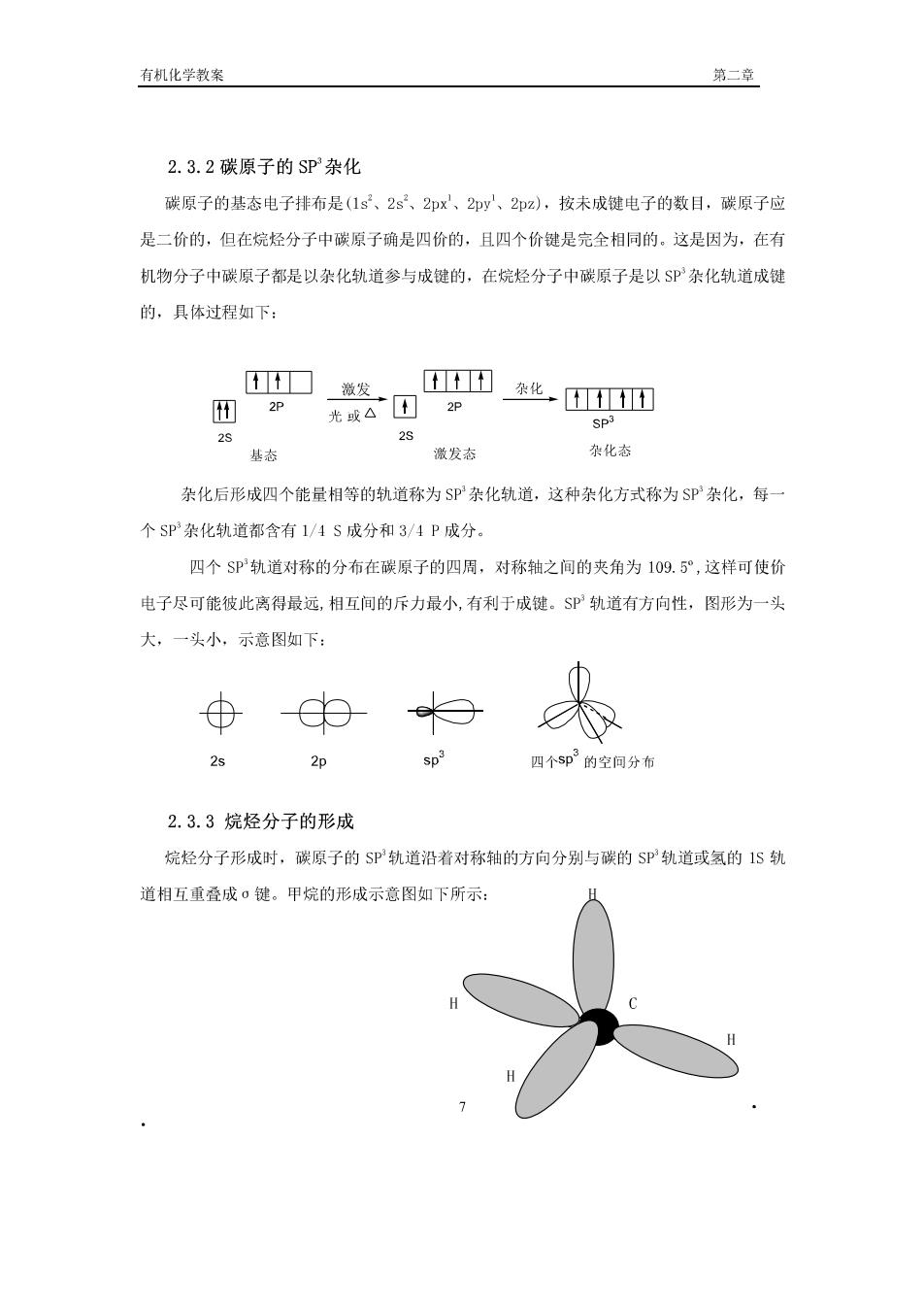
有机化学教案 第二章」 2.3.2碳原子的SP杂化 碳原子的基态电子挂布是(1s、2s2、2px、2py、2pz),按未成键电子的数目,碳原子应 是二价的,但在烷烃分子中碳原子确是四价的,且四个价键是完全相同的,这是因为,在有 机物分子中碳原子都是以杂化轨道参与成键的,在烷烃分子中碳原子是以$P杂化轨道成键 的,具体过程如下: 口微发 田2P 西化四 光吸△2P SPJ 29 25 基态 激发态 杂化态 杂化后形成四个能量相等的轨道称为SP杂化轨道,这种杂化方式称为SP杂化,每 个SP杂化轨道都含有1/4S成分和3/4P成分. 四个SP轨道对称的分布在碳原子的四周,对称轴之间的夹角为109.5°,这样可使价 电子尽可能彼此离得最远,相互间的斥力最小,有利于成键。$P轨道有方向性,图形为一头 大,一头小,示意图如下 2s 四个5即3的空分布 2.3.3烷烃分子的形成 烷经分子形成时,碳原子的SP轨道沿着对称轴的方向分别与碳的SP轨道或氢的1S轨 道相互重叠成。键。甲烷的形成示意图如下所示: