正在加载图片...
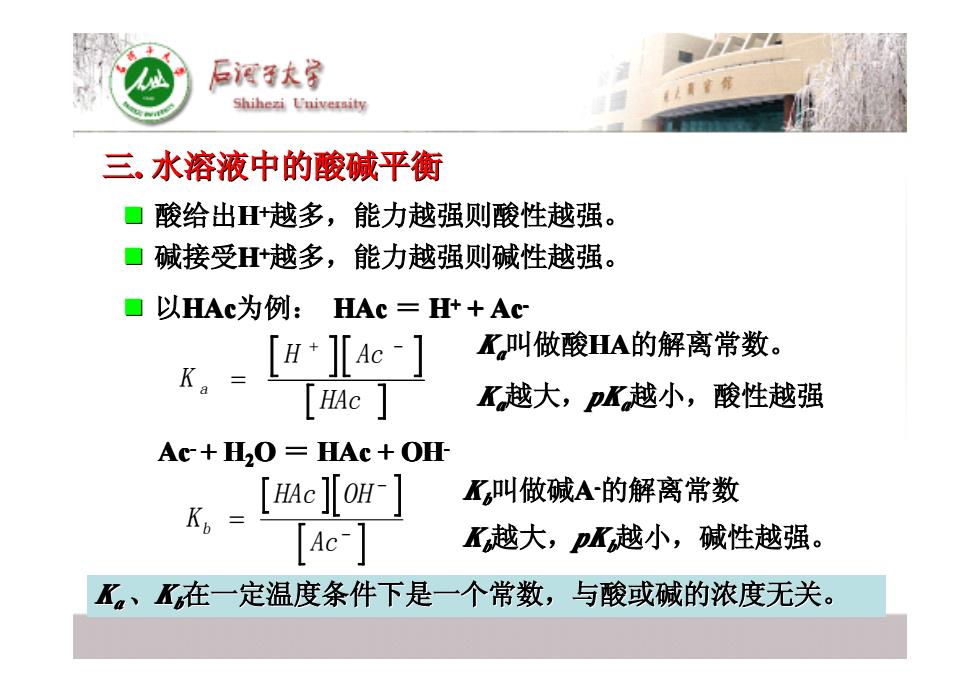
酒节大家 Shihezi University 三、水溶液中的酸碱平衡 ▣酸给出+越多,能力越强则酸性越强。 ☐碱接受H+越多,能力越强则碱性越强。 ■以HAc为例: HAc=H++Ac K叫做酸HA的解离常数。 [HAC K越大,pK越小,酸性越强 Ac+H2O=HAc+OH K,-[e[om-] K叫做碱A的解离常数 Ac- K越大,pK越小,碱性越强。 K。、X在一定温度条件下是一个常数,与酸或碱的浓度无关。 � 酸给出H++越多,能力越强则酸性越强。 越多,能力越强则酸性越强。 � 碱接受H++越多,能力越强则碱性越强。 越多,能力越强则碱性越强。 � 以HAc为例: HAc = H++ + Ac- K H Ac HAc a = + − Ac- + H2O = HAc + OHK HAc OH Ac b = − − Kaa越大,pKaa越小,酸性越强 越小,酸性越强 Kbb越大,pKbb越小,碱性越强。 越小,碱性越强。 Kaa叫做酸HA的解离常数。 Kbb叫做碱A-的解离常数 Ka a、Kbb在一定温度条件下是一个常数,与酸或碱的浓度无关。 在一定温度条件下是一个常数,与酸或碱的浓度无关。 三. 水溶液中的酸碱平衡 水溶液中的酸碱平衡