正在加载图片...
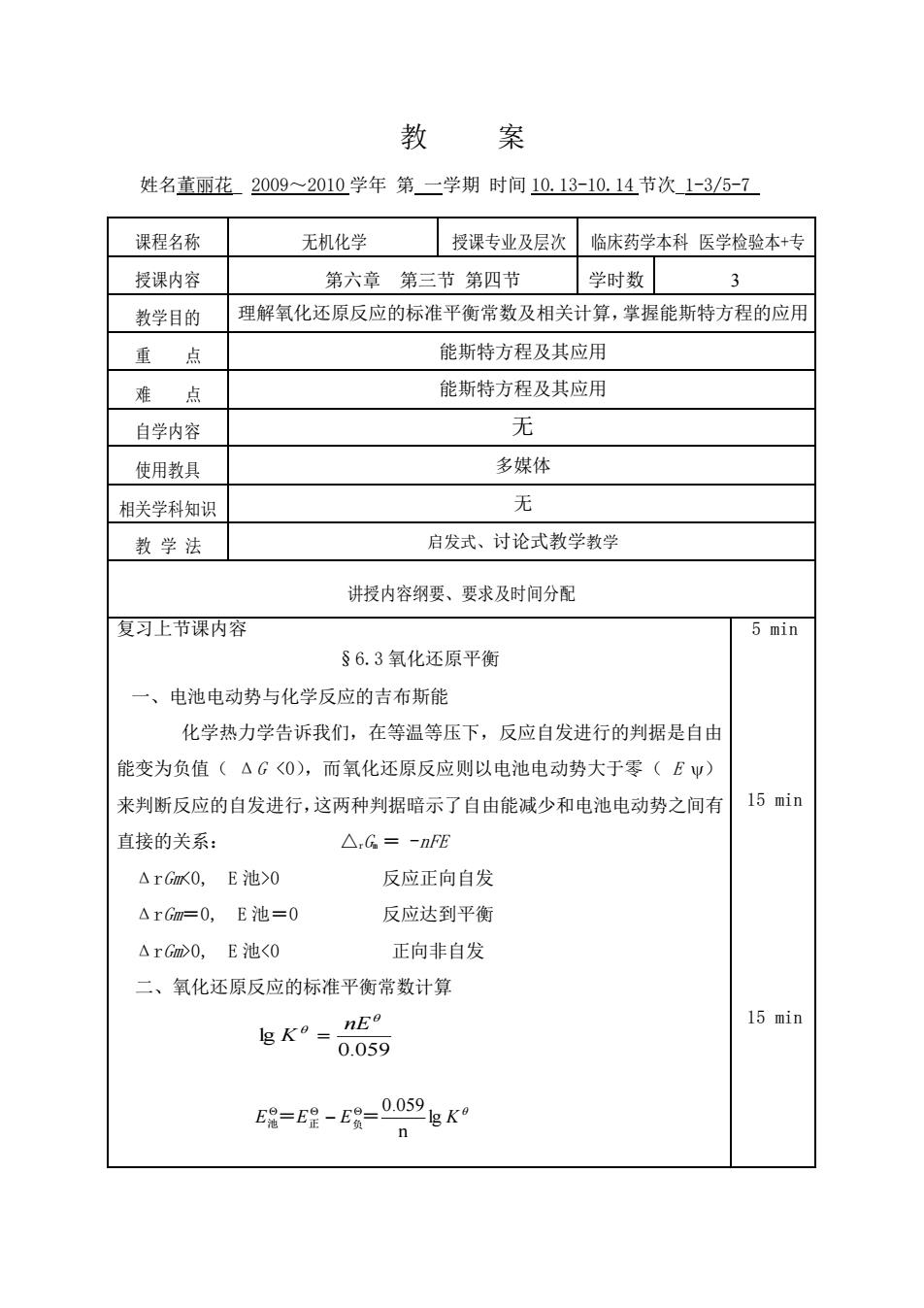
教案 姓名董丽花2009~2010学年第二学期时间10.13-10.14节次1-3/5-7 课程名称 无机化学 授课专业及层次临床药学本科医学检验本+专 授课内容 第六章第三节第四节学时数3 教学目的 理解氧化还原反应的标准平衡常数及相关计算,掌握能斯特方程的应用 重点 能斯特方程及其应用 难点 能斯特方程及其应用 自学内容 无 使用教具 多媒体 相关学科知识 无 教学法 启发式、讨论式教学教学 讲授内容纲要、要求及时间分配 复习上节课内容 5 min §6.3氧化还原平衡 一、电池电动势与化学反应的吉布斯能 化学热力学告诉我们,在等温等压下,反应自发进行的判据是自由 能变为负值(△G<0),而氧化还原反应则以电池电动势大于零(EΨ) 来判断反应的自发进行,这两种判据暗示了自由能减少和电池电动势之间有 15 min 直接的关系: △,G=-nFE △rGx0,E池>0 反应正向自发 △rGm=0,E池=0 反应达到平衡 △rGm>0,E池<0 正向非自发 二、氧化还原反应的标准平衡常数计算 15 min 5g=E2-ER-0059gK n教 案 姓名董丽花_ 2009~2010 学年 第 一学期 时间 10.13-10.14 节次_1-3/5-7_ 课程名称 无机化学 授课专业及层次 临床药学本科 医学检验本+专 授课内容 第六章 第三节 第四节 学时数 3 教学目的 理解氧化还原反应的标准平衡常数及相关计算,掌握能斯特方程的应用 重 点 能斯特方程及其应用 难 点 能斯特方程及其应用 自学内容 无 使用教具 多媒体 相关学科知识 无 教 学 法 启发式、讨论式教学教学 讲授内容纲要、要求及时间分配 复习上节课内容 §6.3 氧化还原平衡 一、电池电动势与化学反应的吉布斯能 化学热力学告诉我们,在等温等压下,反应自发进行的判据是自由 能变为负值( ΔG <0),而氧化还原反应则以电池电动势大于零( E ) 来判断反应的自发进行,这两种判据暗示了自由能减少和电池电动势之间有 直接的关系: △rGm = -nFE ΔrGm<0, E 池>0 反应正向自发 ΔrGm=0, E 池=0 反应达到平衡 ΔrGm>0, E 池<0 正向非自发 二、氧化还原反应的标准平衡常数计算 5 min 15 min 15 min 0.059 lg nE K = E E E lg K n 0.059 池 = 正 − 负 =