正在加载图片...
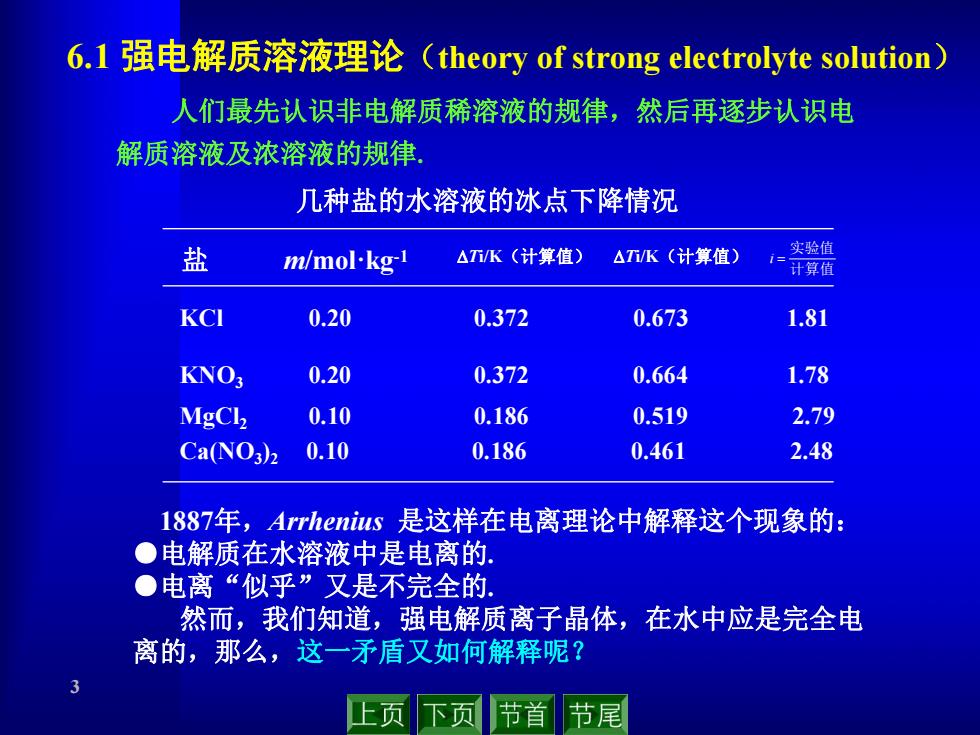
6.1强电解质溶液理论(theory of strong electrolyte solution) 人们最先认识非电解质稀溶液的规律,然后再逐步认识电 解质溶液及浓溶液的规律 几种盐的水溶液的冰点下降情况 盐 m/mol-kg-1 △T/K(计算值) △T/K(计算值) 7=实验值 计算值 KCI 0.20 0.372 0.673 1.81 KNO; 0.20 0.372 0.664 1.78 MgCl 0.10 0.186 0.519 2.79 Ca(NO3)2 0.10 0.186 0.461 2.48 1887年,Arrhenius是这样在电离理论中解释这个现象的: ●电解质在水溶液中是电离的. ●电离“似乎”又是不完全的 然而,我们知道,强电解质离子晶体,在水中应是完全电 离的,那么,这一矛盾又如何解释呢? 止页下节首节尾3 6.1 强电解质溶液理论(theory of strong electrolyte solution) 人们最先认识非电解质稀溶液的规律,然后再逐步认识电 解质溶液及浓溶液的规律. 几种盐的水溶液的冰点下降情况 盐 m/mol·kg-1 Ti/K(计算值) Ti/K(计算值) 计算值 实验值 i KCl 0.20 0.372 0.673 1.81 KNO3 0.20 0.372 0.664 1.78 MgCl2 0.10 0.186 0.519 2.79 Ca(NO3)2 0.10 0.186 0.461 2.48 1887年,Arrhenius 是这样在电离理论中解释这个现象的: ●电解质在水溶液中是电离的. ●电离“似乎”又是不完全的. 然而,我们知道,强电解质离子晶体,在水中应是完全电 离的,那么,这一矛盾又如何解释呢?