正在加载图片...
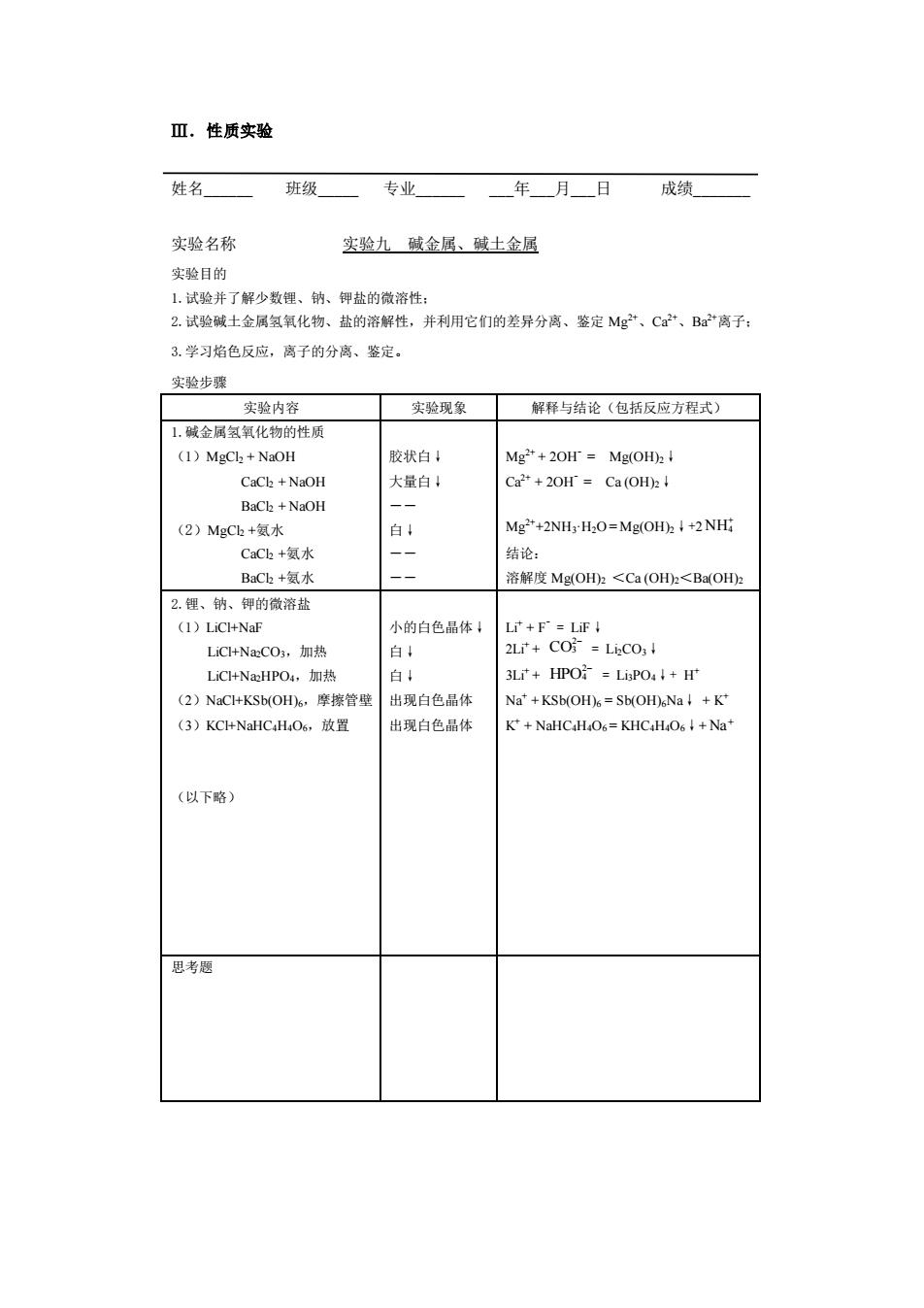
Ⅲ.性质实验 姓名 班级 专业 年月日成绩 实验名称 实验九破金居、破土金屈 实验目的 1.试验并了解少数锂、钠、钾盐的微溶性: 2.试验碱土金属氢氧化物、盐的溶解性,并利用它们的差异分离、鉴定Mg”、C”、B”离子: 3.学习焰色反应,离子的分离、整定 实验步骤 实验内容 实验现象 解释与结论(包括反应方程式) 1.碱金属氢氧化物的性质 (1)MgCl+NaOH 胶状白! Mg"+20H=Mg(OH):! CaCh +NaOH 大量白 C2+20Hr=Ca(oHh↓ BaCk +NaOH (2)MgCb+氨水 Mg*+2NH:H:O=Mg(OH)I+2NHi CCk+氨水 一 结论 BaC+氨水 溶解度MgOH2<Ca(OH2<Ba(OHz 2.锂、钠、每的微济盐 小的白色品体 L+F=LFI LC+NaCO,加热 2L+co防=Lic01 LiC+Na:HPO4,加热 白4 3Lr+HPO=LiPO4+r (2)NaC+KSb(OH6,摩擦管壁 出现自色品体 Na'+KSb(OH%=Sb(OH%Na+K* (3)KC+NaHC.H.O6,.放置 出现白色品体 K+NaHC H06=KHCH O64+Nat (以下略) 思考题 Ⅲ.性质实验 姓名_ 班级_ 专业_ _年_月_日 成绩_ 实验名称 实验九 碱金属、碱土金属 实验目的 1.试验并了解少数锂、钠、钾盐的微溶性; 2.试验碱土金属氢氧化物、盐的溶解性,并利用它们的差异分离、鉴定 Mg2+、Ca2+、Ba2+离子; 3.学习焰色反应,离子的分离、鉴定。 实验步骤 实验内容 实验现象 解释与结论(包括反应方程式) 1.碱金属氢氧化物的性质 (1)MgCl2 + NaOH CaCl2 + NaOH BaCl2 + NaOH (2)MgCl2 +氨水 CaCl2 +氨水 BaCl2 +氨水 胶状白↓ 大量白↓ ―― 白↓ ―― ―― Mg2+ + 2OH- = Mg(OH)2↓ Ca2+ + 2OH- = Ca (OH)2↓ Mg2++2NH3·H2O = Mg(OH)2↓+2 NH4 + 结论: 溶解度 Mg(OH)2 <Ca (OH)2<Ba(OH)2 2.锂、钠、钾的微溶盐 (1)LiCl+NaF LiCl+Na2CO3,加热 LiCl+Na2HPO4,加热 (2)NaCl+KSb(OH)6,摩擦管壁 (3)KCl+NaHC4H4O6,放置 (以下略) 小的白色晶体↓ 白↓ 白↓ 出现白色晶体 出现白色晶体 Li+ + F- = LiF↓ 2Li+ + CO2 3 − = Li2CO3↓ 3Li+ + HPO2 4 − = Li3PO4↓+ H + Na+ + KSb(OH)6 = Sb(OH)6Na↓ + K + K + + NaHC4H4O6 = KHC4H4O6↓+ Na+ 思考题