正在加载图片...
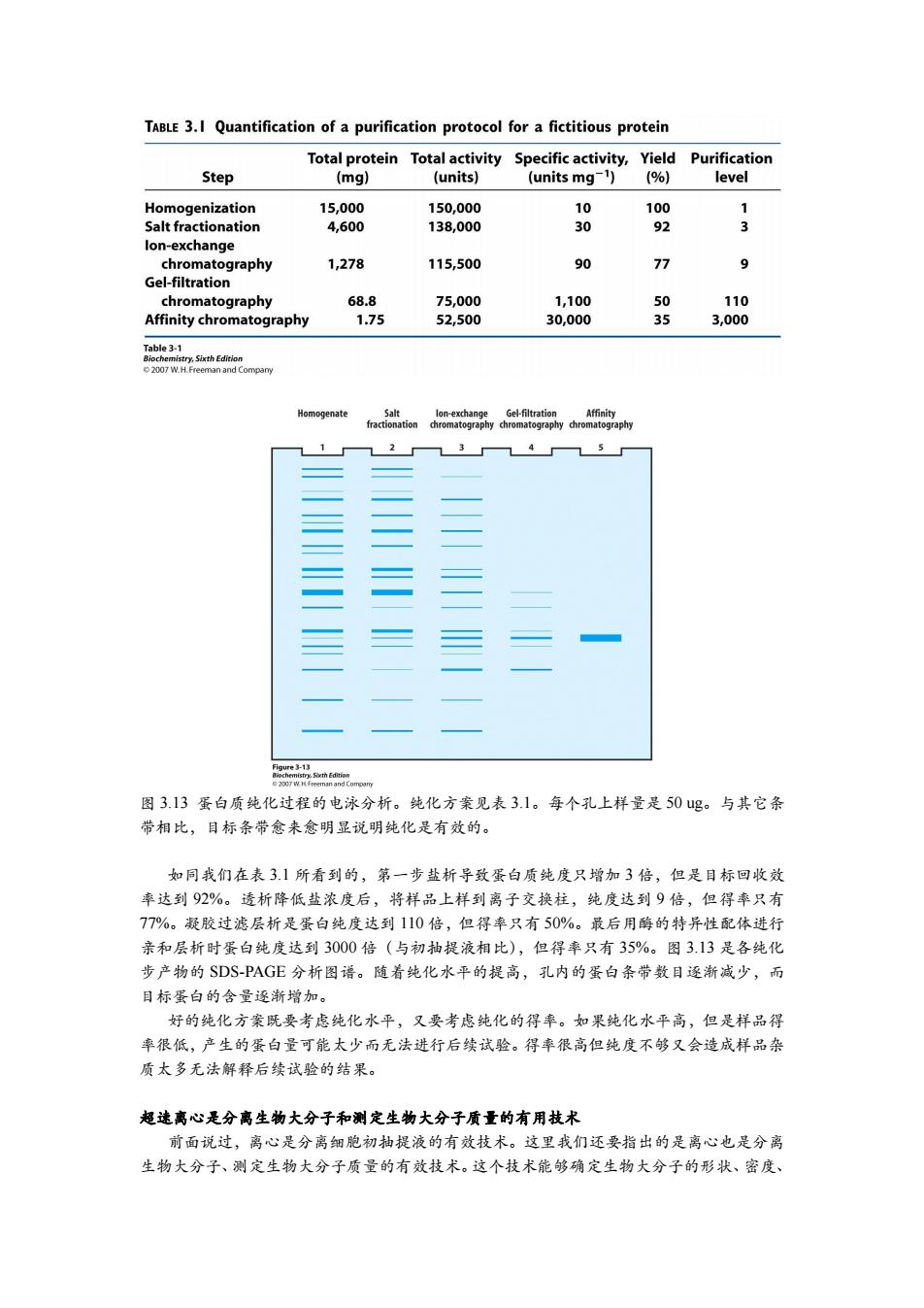
TABLE 3.I Quantification of a purification protocol for a fictitious protein Total protein Total activity Specific activity,Yield Purification Step (mg) (units) (units mg-1)(%) level Homogenization 15,000 150,000 10 100 Salt fractionation 4,600 138,000 30 92 3 lon-exchange chromatography 1,278 115,500 90 77 9 Gel-filtration chromatography 68.8 75,000 1,100 50 110 Affinity chromatography 1.75 52,500 30,000 35 3,000 Table3-1 Biochemistry,Sixth Edition 2007 W.H.Freeman and Compary Homogenate Salt lon-exchange Gel-filtration Affinity fractionation chromatography chromatography chromatography 1 2 3 4 5 图313蛋白质纯化过程的电泳分析。纯化方案见表3.1。每个孔上样量是50ug。与其它条 带相比,目标条带念来愈明显说明纯化是有效的。 如同我们在表3】所看到的,第一步盐析导致蛋白质纯度只增加3倍,但是目标回收效 率达到92%。透析降低盐浓度后,将样品上样到离子交换柱,纯度达到9倍,但得率只有 77%。凝胶过滤层析是蛋白纯度达到110倍,但得率只有50%。最后用酶的特异性配体进行 亲和层析时蛋白纯度达到3000倍(与初抽提液相比),但得率只有35%。图3.13是各纯化 步产物的SDS-PAGE分析图谱。随着纯化水平的提高,孔内的蛋白条带数目逐渐减少,而 目标蛋白的含量逐渐增加。 好的纯化方案既要考虑纯化水平,又要考虑纯化的得率。如果纯化水平高,但是样品得 率很低,产生的蛋白量可能太少而无法进行后续试验。得率很高但纯度不够又会造成样品杂 质太多无法解释后续试验的结果。 超速离心是分离生物大分子和测定生物大分子质量的有用技术 前面说过,离心是分离细胞初抽提液的有效技术。这里我们还要指出的是离心也是分离 生物大分子、测定生物大分子质量的有效技术。这个技术能够确定生物大分子的形状、密度、图 3.13 蛋白质纯化过程的电泳分析。纯化方案见表 3.1。每个孔上样量是 50 ug。与其它条 带相比,目标条带愈来愈明显说明纯化是有效的。 如同我们在表 3.1 所看到的,第一步盐析导致蛋白质纯度只增加 3 倍,但是目标回收效 率达到 92%。透析降低盐浓度后,将样品上样到离子交换柱,纯度达到 9 倍,但得率只有 77%。凝胶过滤层析是蛋白纯度达到 110 倍,但得率只有 50%。最后用酶的特异性配体进行 亲和层析时蛋白纯度达到 3000 倍(与初抽提液相比),但得率只有 35%。图 3.13 是各纯化 步产物的 SDS-PAGE 分析图谱。随着纯化水平的提高,孔内的蛋白条带数目逐渐减少,而 目标蛋白的含量逐渐增加。 好的纯化方案既要考虑纯化水平,又要考虑纯化的得率。如果纯化水平高,但是样品得 率很低,产生的蛋白量可能太少而无法进行后续试验。得率很高但纯度不够又会造成样品杂 质太多无法解释后续试验的结果。 超速离心是分离生物大分子和测定生物大分子质量的有用技术 前面说过,离心是分离细胞初抽提液的有效技术。这里我们还要指出的是离心也是分离 生物大分子、测定生物大分子质量的有效技术。这个技术能够确定生物大分子的形状、密度