正在加载图片...
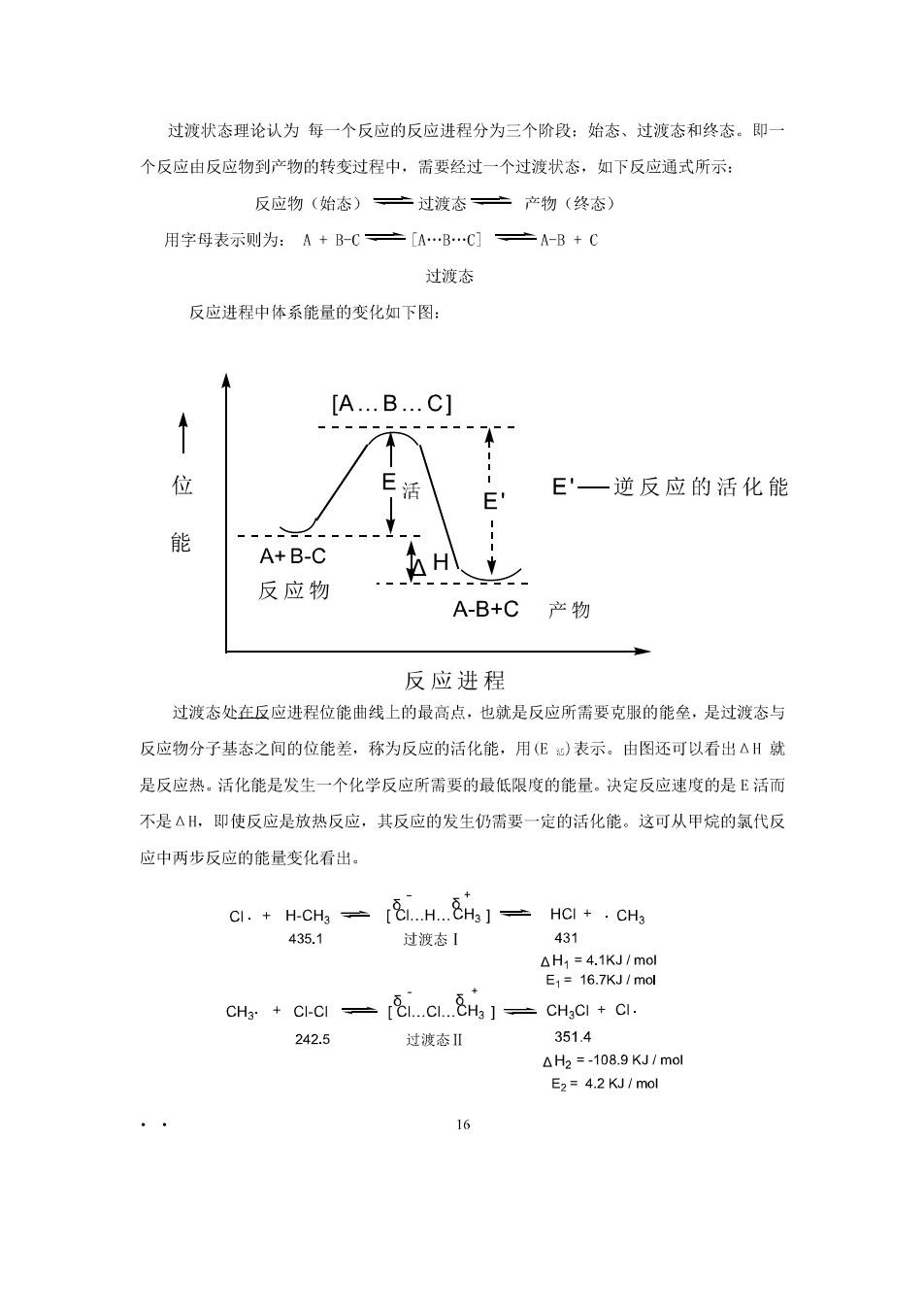
过渡状态理论认为每一个反应的反应进程分为三个阶段:始态、过渡态和终态。即 个反应由反应物到产物的转变过程中,需要经过一个过波状态,如下反应通式所示: 反应物(始态)亡过渡态二产物(终态) 用字母表示则为:A+B-C产[AB…C] 之A-B+C 过渡态 反应进程中体系能量的变化如下图: [A..B..C] 位 E'一逆反应的活化能 A+B-C 反应物 A-B+C产物 反应进程 过渡态处在反应进程位能曲线上的最高点,也就是反应所需要克服的能垒,是过渡态与 反应物分子基态之间的位能差,称为反应的活化能,用(E)表示。由图还可以看出△H新 是反应热。活化能是发生一个化学反应所需要的最低限度的能量。决定反应速度的是E活而 不是△H,即使反应是放热反应,其反应的发生仍需要一定的活化能。这可从甲烷的氯代反 应中两步反应的能量变化看出。 过渡态【 431 CHa CI-CI...CI...CH ]CHgCI CI. 242.5 过波态Ⅱ 351.4