正在加载图片...
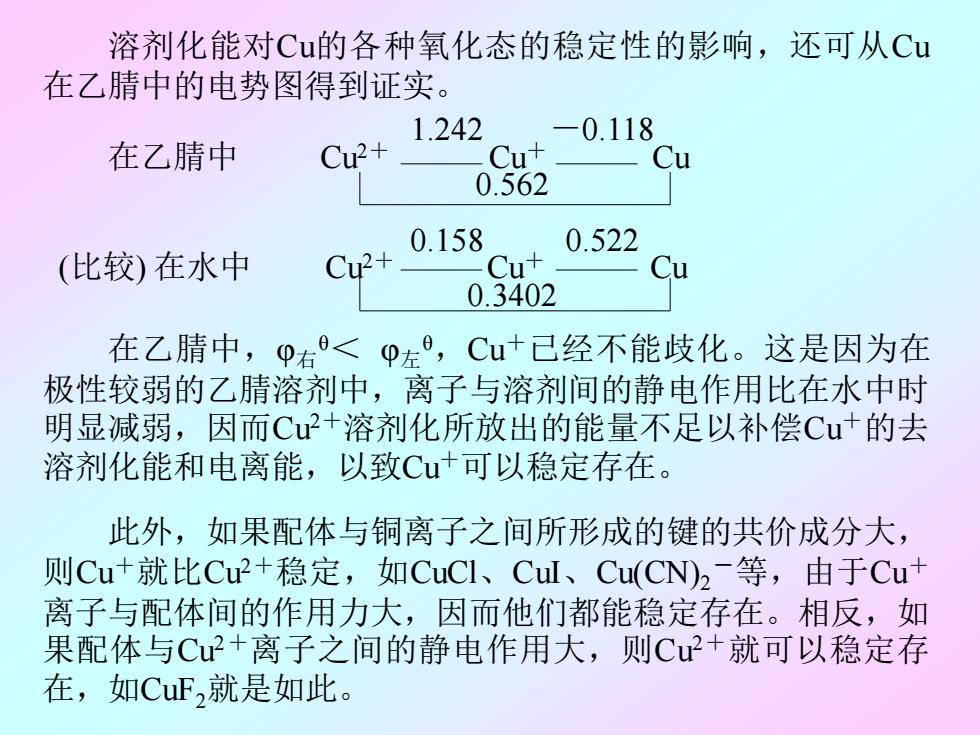
溶剂化能对Cu的各种氧化态的稳定性的影响,还可从Cu 在乙腈中的电势图得到证实。 1.242 -0.118 在乙腈中 Cu2+ Cu+ Cu 0.562 0.158 0.522 (比较)在水中 Cu2+ Cut 0.3402 在乙腈中,p右<p左,Cu+已己经不能歧化。这是因为在 极性较弱的乙腈溶剂中,离子与溶剂间的静电作用比在水中时 明显减弱,因而Cu2+溶剂化所放出的能量不足以补偿Cu+的去 溶剂化能和电离能,以致Cu+可以稳定存在。 此外,如果配体与铜离子之间所形成的键的共价成分大, 则Cu+就比Cu2+稳定,如CuCI、Cul、Cu(CN)2-等,由于Cut 离子与配体间的作用力大,因而他们都能稳定存在。相反,如 果配体与Cu+离子之间的静电作用大,则Cu+就可以稳定存 在,如CuF,就是如此。 溶剂化能对Cu的各种氧化态的稳定性的影响,还可从Cu 在乙腈中的电势图得到证实。 1.242 -0.118 在乙腈中 Cu2+ Cu+ Cu 0.562 0.158 0.522 (比较) 在水中 Cu2+ Cu+ Cu 0.3402 在乙腈中,φ右 θ< φ左 θ ,Cu+已经不能歧化。这是因为在 极性较弱的乙腈溶剂中,离子与溶剂间的静电作用比在水中时 明显减弱,因而Cu2+溶剂化所放出的能量不足以补偿Cu+的去 溶剂化能和电离能,以致Cu+可以稳定存在。 此外,如果配体与铜离子之间所形成的键的共价成分大, 则Cu+就比Cu2+稳定,如CuCl、CuI、Cu(CN)2 -等,由于Cu+ 离子与配体间的作用力大,因而他们都能稳定存在。相反,如 果配体与Cu2+离子之间的静电作用大,则Cu2+就可以稳定存 在,如CuF2就是如此