正在加载图片...
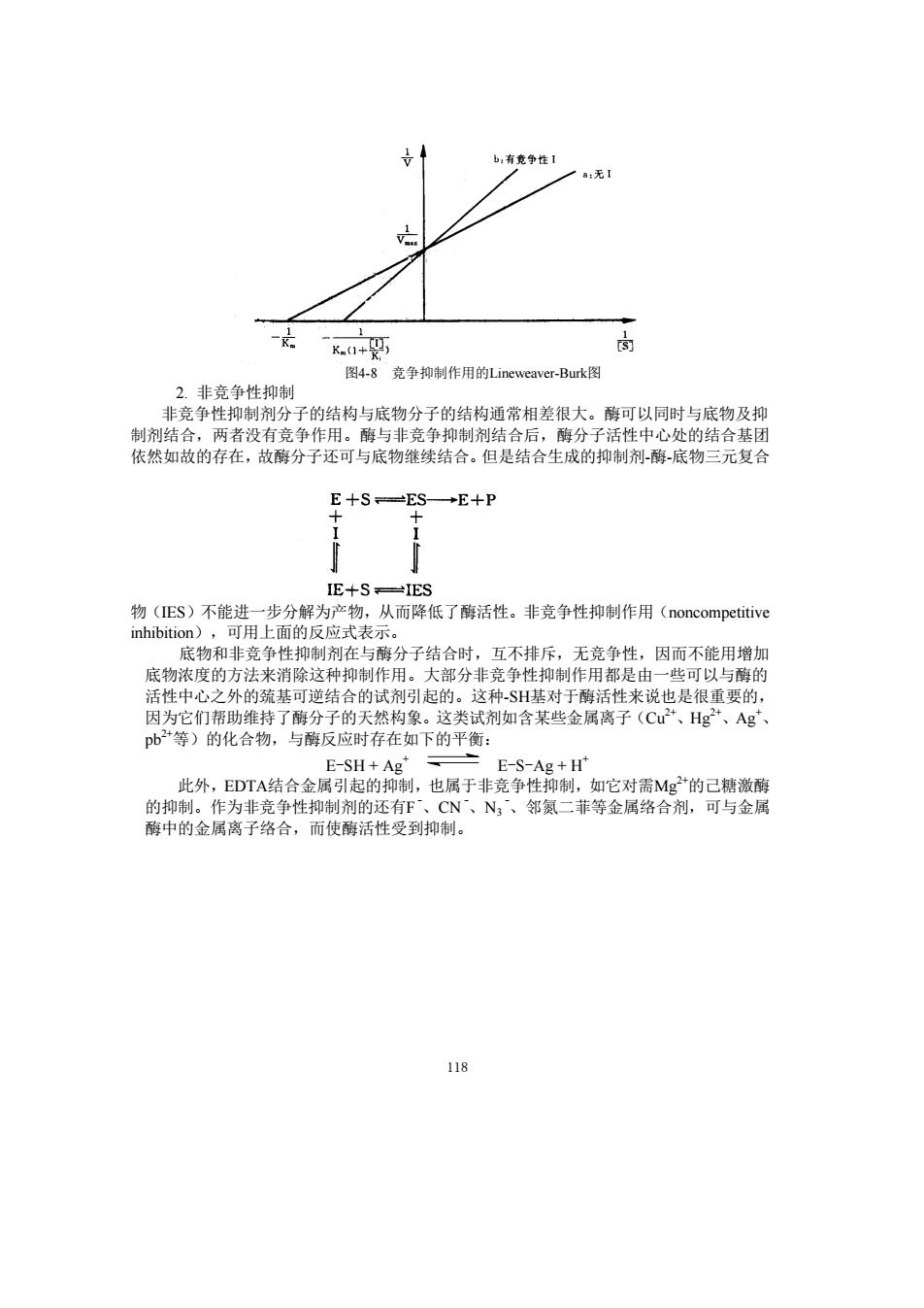
b,有意争性1 无 图4-8 克争抑制作用的Lineweaver-Burk图 2.非竞争性抑制 非竞争性抑制剂分子的结构与底物分子的结构通常相差很大。酶可以同时与底物及抑 制剂结合,两者没有竞争作用。酶与非竞争抑制剂结合后,酶分子活性中心处的结合基团 依然如故的存在,故酶分子还可与底物继续结合。但是结合生成的抑制剂酶-底物三元复合 E+S=ES→E+P IE+S一IES 物(ES)不能进一步分解为产物,从而降低了酶活性。非竞争性抑制作用(noncompetitive inhibition),可用上面的反应式表示。 底物和非竞争性抑制剂在与酶分子结合时, 互不排斥,无竞争性,因而不能用增加 底物浓度的方法来 消除这种抑制 F用e 大都分 些可以 的 性 们帮国 的巯基可逆结 种SH 于酶活性米说也是很 重要的 pb等)的化合物写 剂如含某些金属离子(C、Hg、Ag 下的平衡 E-S-Ag+H" 此外 DA结合金阳+A ,也属于非竞争性 ,如它对需Mg的己糖激 有 、N、邻氮二菲等金属络合剂,可与金展 118 118 图4-8 竞争抑制作用的Lineweaver-Burk图 2. 非竞争性抑制 非竞争性抑制剂分子的结构与底物分子的结构通常相差很大。酶可以同时与底物及抑 制剂结合,两者没有竞争作用。酶与非竞争抑制剂结合后,酶分子活性中心处的结合基团 依然如故的存在,故酶分子还可与底物继续结合。但是结合生成的抑制剂-酶-底物三元复合 物(IES)不能进一步分解为产物,从而降低了酶活性。非竞争性抑制作用(noncompetitive inhibition),可用上面的反应式表示。 底物和非竞争性抑制剂在与酶分子结合时,互不排斥,无竞争性,因而不能用增加 底物浓度的方法来消除这种抑制作用。大部分非竞争性抑制作用都是由一些可以与酶的 活性中心之外的巯基可逆结合的试剂引起的。这种-SH基对于酶活性来说也是很重要的, 因为它们帮助维持了酶分子的天然构象。这类试剂如含某些金属离子(Cu 2+、Hg 2+、Ag +、 pb 2+等)的化合物,与酶反应时存在如下的平衡: E-SH + Ag + E-S-Ag + H + 此外,EDTA结合金属引起的抑制,也属于非竞争性抑制,如它对需Mg 2+的己糖激酶 的抑制。作为非竞争性抑制剂的还有F -、CN -、N3 -、邻氮二菲等金属络合剂,可与金属 酶中的金属离子络合,而使酶活性受到抑制