正在加载图片...
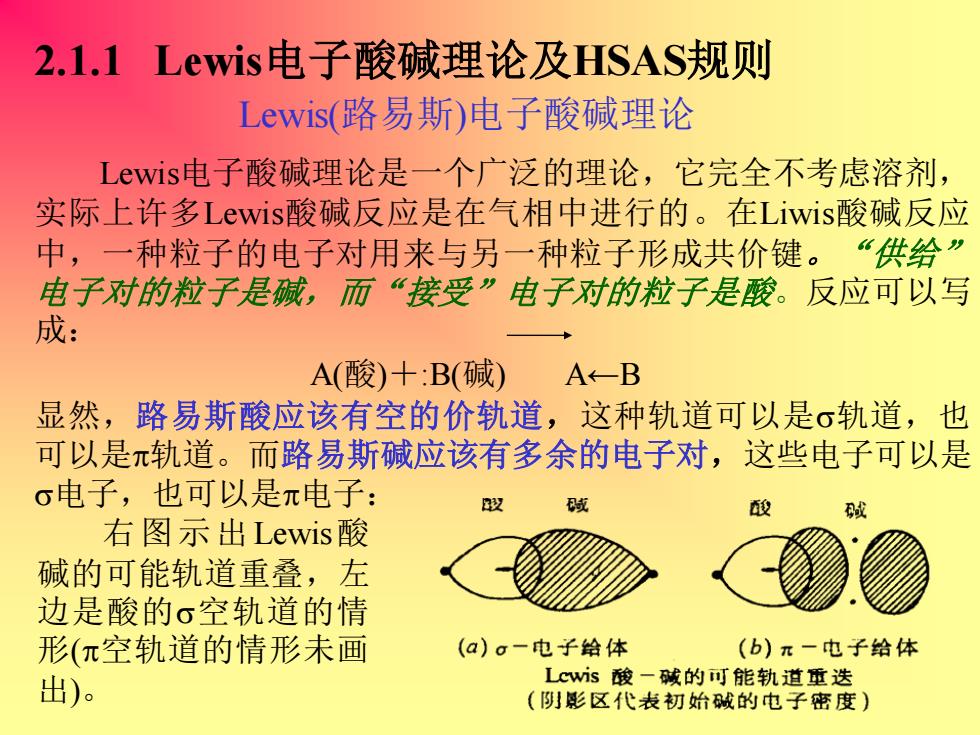
2.1.1 Lewis电子酸碱理论及HSAS规则 Lewis(路易斯)电子酸碱理论 Lewist电子酸碱理论是一个广泛的理论,它完全不考虑溶剂, 实际上许多Lewis酸碱反应是在气相中进行的。在Liwis酸碱反应 中,一种粒子的电子对用来与另一种粒子形成共价键。“供给” 电子对的粒子是碱,而“接受”电子对的粒子是酸。反应可以写 成: A(酸)十:B(碱)A←-B 显然,路易斯酸应该有空的价轨道,这种轨道可以是σ轨道,也 可以是π轨道。而路易斯碱应该有多余的电子对,这些电子可以是 σ电子,也可以是π电子: 段 酸 右图示出Lewisi酸 碱的可能轨道重叠,左 边是酸的σ空轨道的情 形(π空轨道的情形未画 (a)g一电子给体 (b)π一电子给体 出) Lcws酸一碱的可能轨道重迭 (阴影区代表初始碱的电子密度) 2.1.1 Lewis电子酸碱理论及HSAS规则 右图示出Lewis酸 碱的可能轨道重叠,左 边是酸的空轨道的情 形(空轨道的情形未画 出)。 Lewis(路易斯)电子酸碱理论 Lewis电子酸碱理论是一个广泛的理论,它完全不考虑溶剂, 实际上许多Lewis酸碱反应是在气相中进行的。在Liwis酸碱反应 中,一种粒子的电子对用来与另一种粒子形成共价键。 “供给” 电子对的粒子是碱,而“接受”电子对的粒子是酸。反应可以写 成: A(酸)+:B(碱) A←B 显然,路易斯酸应该有空的价轨道,这种轨道可以是轨道,也 可以是轨道。而路易斯碱应该有多余的电子对,这些电子可以是 电子,也可以是电子: