
第二章酸碱和溶剂化学 基本要求 酸碱概念 路易斯电子酸碱理论及HSAB规则质子酸碱和质子溶剂 溶剂化学 水合焓非水质子溶剂体系(酸性质子溶剂碱性质子溶剂、 亲核质子溶剂类水两性溶剂) 非质子溶剂体系(van der Waalsi溶剂Lewis减溶剂 离子传递溶剂熔盐体系) 酸碱强度的量度 水溶液中质子酸碱的强度(影响质子酸碱强度的因素 水溶液中质子酸碱的强度含氧酸的酸性) 非水溶剂中的质子酸碱的强度 电子酸碱的强度 超酸和魔酸 习题:1,2,3,4,8
第二章 酸碱和溶剂化学 基 本 要 求 酸碱概念 路易斯电子酸碱理论及HSAB规则 质子酸碱和质子溶剂 溶剂化学 水合焓 非水质子溶剂体系(酸性质子溶剂 碱性质子溶剂、 亲核质子溶剂 类水两性溶剂) 非质子溶剂体系(van der Waals溶剂 Lewis碱溶剂 离子传递溶剂 熔盐体系) 酸碱强度的量度 水溶液中质子酸碱的强度(影响质子酸碱强度的因素 水溶液中质子酸碱的强度 含氧酸的酸性) 非水溶剂中的质子酸碱的强度 电子酸碱的强度 超酸和魔酸 习题:1,2,3,4,8

2.1酸碱概念 酸和碱不能简单地分别定义为在电离时会产生H+离 子和OH一离子的物质。 即使是酸,在水溶液中也不能产生游离的H+离子。 由于H+是一个裸露的原子核,其半径极小,为L+离 子半径的五万分之一,其电荷密度(e/r2)很大(为Li+离子 的2.5×10倍),易与水分子的氧生成氢键。换句话说,裸 露的原子核在水中是不可能稳定存在的,易被水合
酸和碱不能简单地分别定义为在电离时会产生H+离 子和OH-离子的物质。 即使是酸,在水溶液中也不能产生游离的H+离子。 由于H+是一个裸露的原子核,其半径极小,为Li+离 子半径的五万分之一,其电荷密度(e/r 2 )很大(为Li+离子 的2.5×109倍),易与水分子的氧生成氢键。换句话说,裸 露的原子核在水中是不可能稳定存在的,易被水合。 2.1 酸碱概念

H+(g)离子水合时放出大量的热量: H20 H+(g) H+(aq)H0=-1091.1kJ.mol-1 如此多的热量表明水合趋势很大,H+在水中是同水分子 结合在一起而存在的: 如H H H H0: H>0.H. H (H,O+) (H02+) 酸在水中产生的是H,O+(写成HO+是一种简化,意指H+ 是与H,O结合在一起的): H0.H OH]++CI- 此外,在某些离子型晶体中也存在氧离子HO+,如 H3O+ClO4
H+(g)离子水合时放出大量的热量: H+(g) H+(aq) △Hθ=-1091.1 kJ·mol-1 如此多的热量表明水合趋势很大,H+在水中是同水分子 结合在一起而存在的: 如 H H H H O: H O······H O H H (H3O+) (H5O2 +) 酸在水中产生的是H3O+(写成H3O+是一种简化, 意指H+ 是与H2O结合在一起的): H H H H 此外,在某些离子型晶体中也存在氧离子H3O+ ,如 H3O+ClO4 -。 O ······H Cl → [ O H]+ + Cl- H2O
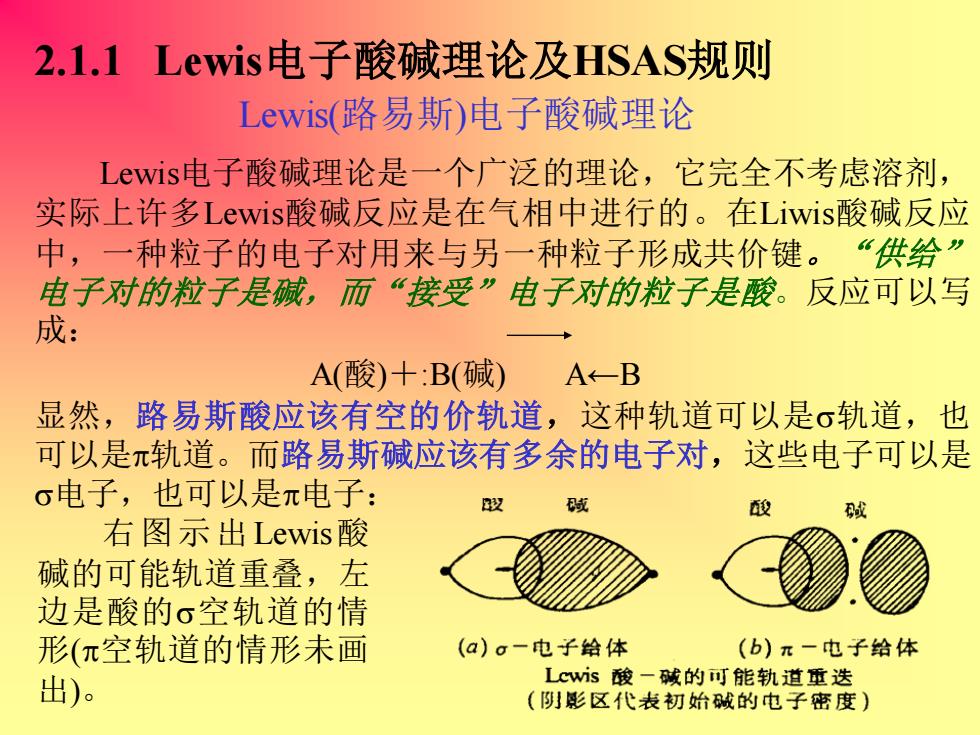
2.1.1 Lewis电子酸碱理论及HSAS规则 Lewis(路易斯)电子酸碱理论 Lewist电子酸碱理论是一个广泛的理论,它完全不考虑溶剂, 实际上许多Lewis酸碱反应是在气相中进行的。在Liwis酸碱反应 中,一种粒子的电子对用来与另一种粒子形成共价键。“供给” 电子对的粒子是碱,而“接受”电子对的粒子是酸。反应可以写 成: A(酸)十:B(碱)A←-B 显然,路易斯酸应该有空的价轨道,这种轨道可以是σ轨道,也 可以是π轨道。而路易斯碱应该有多余的电子对,这些电子可以是 σ电子,也可以是π电子: 段 酸 右图示出Lewisi酸 碱的可能轨道重叠,左 边是酸的σ空轨道的情 形(π空轨道的情形未画 (a)g一电子给体 (b)π一电子给体 出) Lcws酸一碱的可能轨道重迭 (阴影区代表初始碱的电子密度)
2.1.1 Lewis电子酸碱理论及HSAS规则 右图示出Lewis酸 碱的可能轨道重叠,左 边是酸的空轨道的情 形(空轨道的情形未画 出)。 Lewis(路易斯)电子酸碱理论 Lewis电子酸碱理论是一个广泛的理论,它完全不考虑溶剂, 实际上许多Lewis酸碱反应是在气相中进行的。在Liwis酸碱反应 中,一种粒子的电子对用来与另一种粒子形成共价键。 “供给” 电子对的粒子是碱,而“接受”电子对的粒子是酸。反应可以写 成: A(酸)+:B(碱) A←B 显然,路易斯酸应该有空的价轨道,这种轨道可以是轨道,也 可以是轨道。而路易斯碱应该有多余的电子对,这些电子可以是 电子,也可以是电子:

根据这种反应的实质,可以把路易斯酸称作电子接受 体或亲电试剂,而把路易斯碱叫作电子给予体或亲核试剂。 属于路易斯酸的有: ①正离子,如Cu2+、Ni2+、A13+,这些金属离子包含 有可用于成键的未被占据的价轨道; ②含有价层未充满的原子的化合物,如BX3,A1X3; ③含有价层可扩展的原子的化合物,如SnCl4(利用外层 空d轨道) 属于路易斯碱有: ①阴离子; ②具有孤对电子的中性分子,如NH3、HO等; ③含π键的分子(可将π电子给出)
根据这种反应的实质,可以把路易斯酸称作电子接受 体或亲电试剂,而把路易斯碱叫作电子给予体或亲核试剂。 属于路易斯酸的有: ① 正离子,如Cu2+ 、Ni2+ 、Al3+ ,这些金属离子包含 有可用于成键的未被占据的价轨道; ② 含有价层未充满的原子的化合物,如BX3,AlX3; ③ 含有价层可扩展的原子的化合物,如SnCl4 (利用外层 空d 轨道)。 属于路易斯碱有: ① 阴离子; ② 具有孤对电子的中性分子,如NH3、H2O等; ③ 含 键的分子(可将电子给出)

许多路易斯酸碱反应的实质是酸碱的传递反应: 例如:B:十B’→A=BA十B (碱的置换或酸的传递) A+B→A?=BA十A (酸的置换或碱的传递) B→A十B→A=B→A十B→A (酸碱同时传递)
许多路易斯酸碱反应的实质是酸碱的传递反应: 例如:B:+B’→A = B→A+:B’ (碱的置换或酸的传递) A+B→A’ = B→A+A’ (酸的置换或碱的传递) B→A+B’→A’ = B→A’+B’→A (酸碱同时传递)

研究发现,要判定哪一个路易斯碱强和哪一个弱, 即要对路易斯碱搞一个相对的碱度系统标准是十分困 难的。当用不同的酸作参比标准时,可以得到不同的 碱度系统标准。 如,卤素离子(碱)对A13+离子给电子能力为: I<Br-<Cl-<F 但卤素离子(碱)对Hg+离子的给电子能力却有相反 的顺序: F-<CI-<Br<I 类似的颠倒现象很多。 同样,要对路易斯酸搞一个相对的酸度系统标准 也是十分困难的,当用不同的碱作参比标准时,可以 得到不同的酸度系统标准
研究发现,要判定哪一个路易斯碱强和哪一个弱, 即要对路易斯碱搞一个相对的碱度系统标准是十分困 难的。当用不同的酸作参比标准时,可以得到不同的 碱度系统标准。 如,卤素离子(碱)对Al3+离子给电子能力为: I-<Br-<Cl-<F- 但卤素离子(碱)对Hg2+离子的给电子能力却有相反 的顺序: F-<Cl-<Br-<I- 类似的颠倒现象很多。 同样,要对路易斯酸搞一个相对的酸度系统标准 也是十分困难的,当用不同的碱作参比标准时,可以 得到不同的酸度系统标准

HSAS规则 为了说明上述的颠倒现象,Pearson提出了软硬酸 碱的概念。 把Lwis酸碱分成硬的、交界的和软的酸碱。 软酸、软碱之所以称为软,是形象地表明它们较 易变形; 硬酸、硬碱之所以称为硬,是形象地表明它们不 易变形。 换句话说,软酸或软碱是其价电子容易被极化或 容易失去的酸或碱,而硬酸或硬碱则是其价电子与原 子核结合紧密且不容易被极化或不容易失去的酸或碱
为了说明上述的颠倒现象,Pearson提出了软硬酸 碱的概念。 把Lewis酸碱分成硬的、交界的和软的酸碱。 软酸、软碱之所以称为软,是形象地表明它们较 易变形; 硬酸、硬碱之所以称为硬,是形象地表明它们不 易变形。 换句话说,软酸或软碱是其价电子容易被极化或 容易失去的酸或碱,而硬酸或硬碱则是其价电子与原 子核结合紧密且不容易被极化或不容易失去的酸或碱。 HSAS规则

具体地说,硬酸中接受电子的原子较小、正电 荷高,其价电子轨道不易变形(用一句话说就是硬酸 是受体原子对外层电子的吸引力强的酸)。 像A13+离子以及BF?之类的化合物都是硬酸的例 子。 软酸中接受电子的原子较大、正电荷数且低或者 为0,以易变形的价电子轨道去接受电子(用一句话说 就是软酸是受体原子对外层电子的吸引力弱的酸)。 金属原子、Hg2+离子及InCl3之类化合物即是典 型的软酸
具体地说,硬酸中接受电子的原子较小、正电 荷高, 其价电子轨道不易变形 (用一句话说就是硬酸 是受体原子对外层电子的吸引力强的酸)。 像Al3+离子以及BF3之类的化合物都是硬酸的例 子。 软酸中接受电子的原子较大、正电荷数目低或者 为 0 , 以易变形的价电子轨道去接受电子 (用一句话说 就是软酸是受体原子对外层电子的吸引力弱的酸)。 金属原子、Hg2+离子及InCl3之类化合物即是典 型的软酸

硬碱和软碱可以按照同样的原理处理: 硬碱中的价电子结合紧密,软碱中的价电子容易 被极化。 典型的硬碱是一些较小的阴离子如F离子,对称 的含氧酸阴离子,如CO4,以及具有小的给予体原子 的分子如NH等。 典型的软碱是一些较大的阴离子如I一、H一,或者 含有较大的给予体原子的分子
硬碱和软碱可以按照同样的原理处理: 硬碱中的价电子结合紧密,软碱中的价电子容易 被极化。 典型的硬碱是一些较小的阴离子如F-离子,对称 的含氧酸阴离子,如ClO4 -,以及具有小的给予体原子 的分子如NH3等。 典型的软碱是一些较大的阴离子如I-、H-,或者 含有较大的给予体原子的分子