
第五章化学平衡与滴 定分析法概论
第五章 化学平衡与滴 定分析法概论

·滴定分析法:将标准溶液通过滴定管滴加 到待测溶液中,直到加入的标准溶液与被 测物质按化学计量关系作用完全为止,然 后根据所用标准溶液的浓度和用量(体积) 计算出待测物质含量的分析方法。 滴定分析法:滴定操作过程+计算过程
▪ 滴定分析法:将标准溶液通过滴定管滴加 到待测溶液中,直到加入的标准溶液与被 测物质按化学计量关系作用完全为止,然 后根据所用标准溶液的浓度和用量(体积) 计算出待测物质含量的分析方法。 滴定分析法:滴定操作过程 + 计算过程

直接滴定分析的要求 •反应必须按化学计量关系定量 完成,而且进行完全(要求达 到99.9%以上) •反应要迅速(可借助加热或加催 化剂等方法加速) 。 无副反应发生或可采取适当方 法消除副反应。 必须有比较简便可靠的方法确 定滴定终点
直接滴定分析的要求 •反应必须按化学计量关系定量 完成,而且进行完全(要求达 到99.9﹪以上)。 •反应要迅速(可借助加热或加催 化剂等方法加速) 。 •无副反应发生或可采取适当方 法消除副反应。 •必须有比较简便可靠的方法确 定滴定终点

滴定分析常用术语 ·化学计量点:当加入的滴定剂的量与被测物 质的量正好符合按化学反应式所表示的化学 计量关系时,称反应达到了化学计量点(简 称:计量点Sp)。 女化学计量点是一个理论值
▪ 化学计量点:当加入的滴定剂的量与被测物 质的量正好符合按化学反应式所表示的化学 计量关系时,称反应达到了化学计量点(简 称:计量点sp)。 化学计量点是一个理论值 滴定分析常用术语

指示剂:滴定分析中加入的能发生颜色改变 而指示滴定终点的试剂。 滴定终点:滴定时指示剂颜色改变就停止滴 定的点。 滴定终点误差:由于滴定终点和化学计量点 的不一致所造成的误差,又称为滴定误差 (TE)方法误差)
指示剂:滴定分析中加入的能发生颜色改变 而指示滴定终点的试剂。 滴定终点:滴定时指示剂颜色改变就停止滴 定的点 。 滴定终点误差:由于滴定终点和化学计量点 的不一致所造成的误差,又称为滴定误差 (TE)(方法误差)
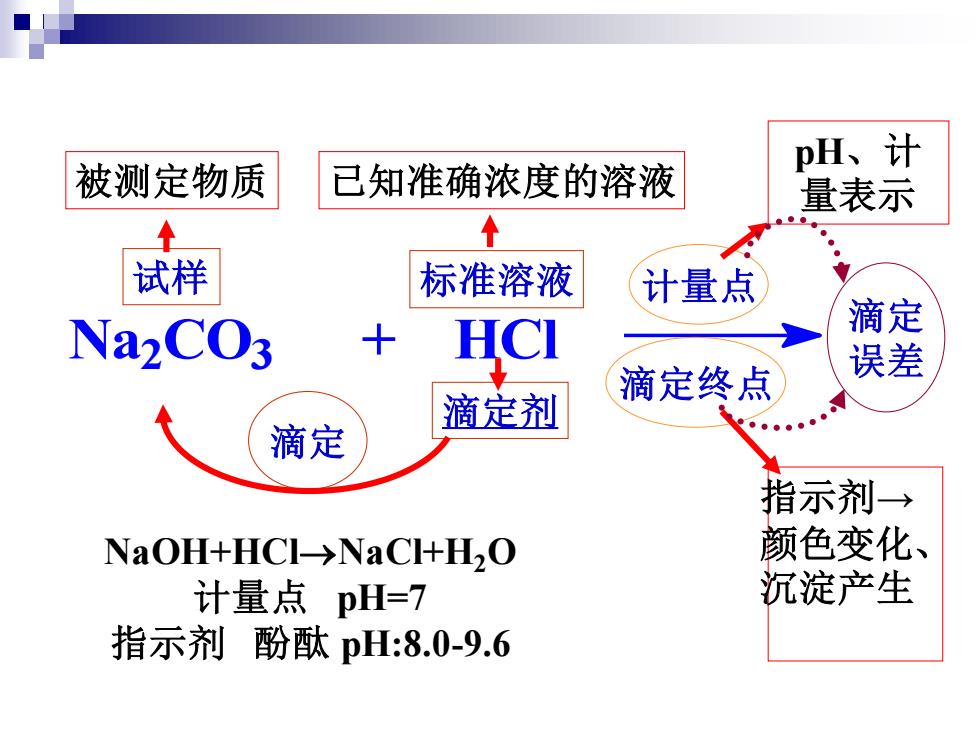
pH、计 被测定物质 已知准确浓度的溶液 量表示 个 试样 标准溶液 计量点 NaCO3 +HCI 滴定 滴定终点 误差 滴定剂 滴定 指示剂→ NaOH+HCl→NaC+H,O 颜色变化、 计量点pH=7 沉淀产生 指示剂酚酞pH:8.0-9.6
Na2 CO3 + HCl 试样 被测定物质 滴定剂 标准溶液 已知准确浓度的溶液 计量点 pH、计 量表示 指示剂→ 颜色变化、 沉淀产生 滴定 误差 滴定终点 NaOH+HCl→NaCl+H2O 计量点 pH=7 指示剂 酚酞 pH:8.0-9.6 滴定

滴定分析法的特点: ● →滴定分析主要用于常量组分和常量分析 →准确度高(相对误差一般在0.2%左右) →仪器设备简单(玻璃仪器),应用广泛 →操作简便、快速,便于多次平行测定,有利于提 高测定结果的准确度 ⑧不足:灵敏度较低
➔滴定分析主要用于常量组分和常量分析 ➔准确度高(相对误差一般在0.2%左右) ➔仪器设备简单(玻璃仪器),应用广泛 ➔操作简便、快速,便于多次平行测定,有利于提 高测定结果的准确度 ⚫滴定分析法的特点: 不足:灵敏度较低

滴定分析的方法(按滴定反应及方式) 酸碱滴定法 ● 直接滴定法 ■配位滴定法 ·返滴定法 ■氧化还原滴定 法 ·置换滴定 ■沉淀滴定法 ●间接滴定法 ■非水滴定法
◼ 酸碱滴定法 ◼ 配位滴定法 ◼ 氧化还原滴定 法 ◼ 沉淀滴定法 ◼ 非水滴定法 滴定分析的方法(按滴定反应及方式) ⚫ 直接滴定法 ⚫ 返滴定法 ⚫ 置换滴定 ⚫ 间接滴定法
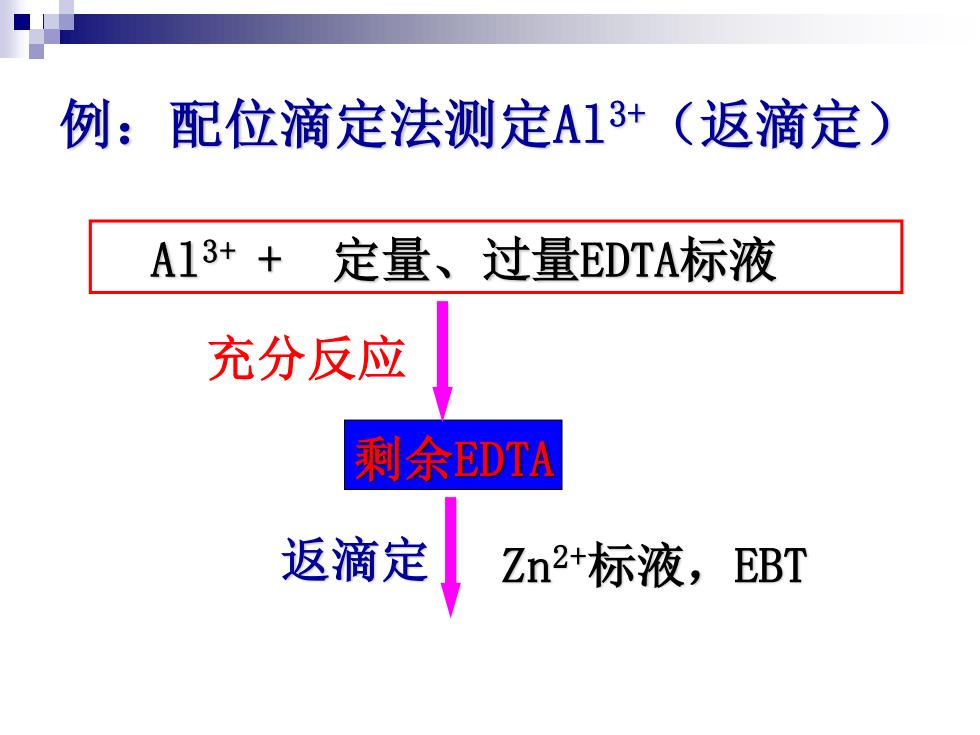
例:配位滴定法测定A13+(返滴定) A13++定量、过量EDTA标液 充分反应 剩余EDTA 返滴定 Zn2+标液,EBT
例:配位滴定法测定Al3+(返滴定) Al3+ + 定量、过量EDTA标液 剩余EDTA Zn 返滴定 2+标液,EBT 充分反应

例2:测固体样品 固体CaCO3+定过量HC标液 剩余HCI标液,NaOH标液 返滴定
例2:测固体样品 固体CaCO3 + 定过量HCl标液 剩余HCl标液 NaOH标液 返滴定