
第一章 原子、分子及元素周期性
第一章 原子、分子及元素周期性

第一节原子结构理论概述 第二节原子参数及元素周期性 第三节共价键理论概述 第四节键参数与分子构型 第五节分子对称性与点群 第六节单质的性质及其周期性递变规律 第七节主族元素化合物的周期性性质 以上七节主要自学,要求掌握: 1用徐光宪的改进的Slateri规则计算电子的屏蔽常数 2了解电负性的几种标度,理解环境对电负性的影响和基 团电负性的概念 3键参数价层电子对互斥理论分子对称性知识 4单质及其化合物的一些性质的周期性变化规律 同时,还要特别注意 5掌握周期反常现象的几种表现形式及合理解释 习题:1,3,6,7,11,13,15,17
第一节 原子结构理论概述 第二节 原子参数及元素周期性 第三节 共价键理论概述 第四节 键参数与分子构型 第五节 分子对称性与点群 第六节 单质的性质及其周期性递变规律 第七节 主族元素化合物的周期性性质 以上七节主要自学,要求掌握: 1 用徐光宪的改进的Slater规则计算电子的屏蔽常数 2 了解电负性的几种标度,理解环境对电负性的影响和基 团电负性的概念 同时,还要特别注意 4 单质及其化合物的一些性质的周期性变化规律 5 掌握周期反常现象的几种表现形式及合理解释 3 键参数 价层电子对互斥理论 分子对称性知识 习题:1,3,6,7,11,13,15, 17

1原子的性质 (1)屏蔽常数 Slater/屏蔽常数规则 。将原子中的电子分组 (1s);(2s,2p);3s,3p)3d);(4s,4p)(4d)(4fD;5s,5p);5d);5f等 ●位于某小组电子后面的各组,对该组的屏蔽常数σ=0, 近似地可以理解为外层电子对内存电子没有屏蔽作用; ●同组电子间的o=0.35(1s例外,1s的σ=0.30); ●对于ns或np上的电子,(m一1)电子层中的电子的屏蔽常数 o=0.85,小于(n一1)的各层中的电子的屏蔽常数σ=1.00; ●对于nd或nf上的电子,位于它左边的各组电子对它们的 屏蔽常数o=1.00
1 原子的性质 (1) 屏蔽常数 Slater屏蔽常数规则 将原子中的电子分组 (1s);(2s,2p);(3s,3p);(3d);(4s,4p);(4d);(4f);(5s,5p);(5d);(5f)等 位于某小组电子后面的各组,对该组的屏蔽常数=0, 近似地可以理解为外层电子对内存电子没有屏蔽作用; 同组电子间的=0.35 (1s例外,1s的=0.30); 对于ns或np上的电子,(n-1)电子层中的电子的屏蔽常数 =0.85,小于(n-1)的各层中的电子的屏蔽常数=1.00; 对于nd或nf上的电子,位于它左边的各组电子对它们的 屏蔽常数=1.00
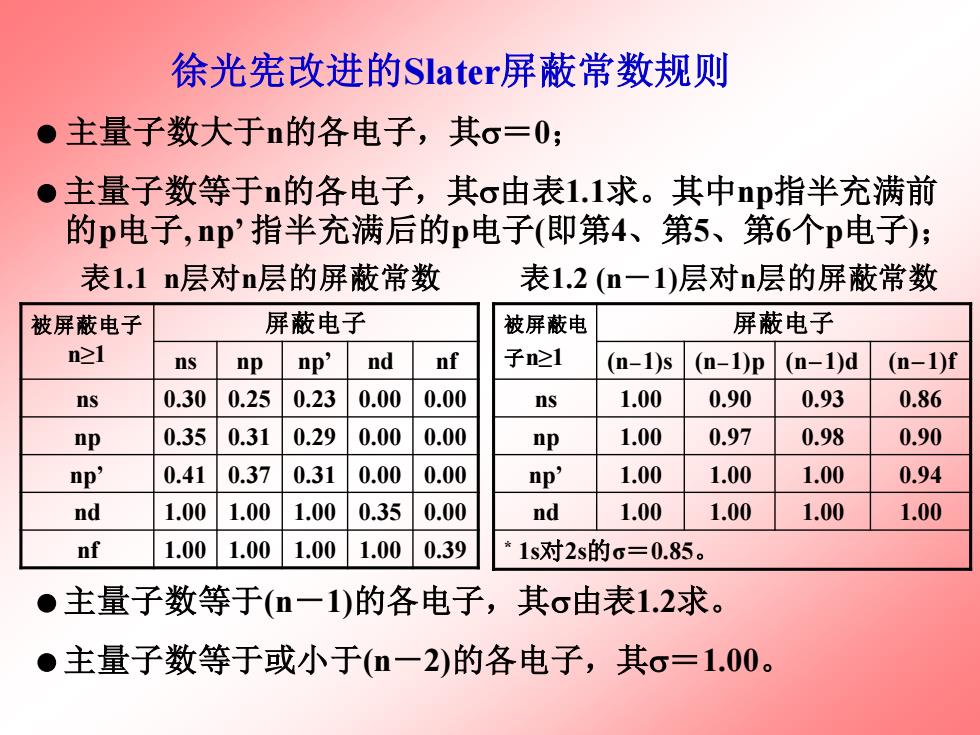
徐光宪改进的Slater屏蔽常数规则 ●主量子数大于n的各电子,其o=0; ●主量子数等于n的各电子,其o由表1.1求。其中np指半充满前 的p电子,np'指半充满后的p电子(即第4、第5、第6个p电子); 表1.1n层对n层的屏蔽常数 表1.2(n一1)层对n层的屏蔽常数 被屏蔽电子 屏蔽电子 被屏蔽电 屏蔽电子 n21 ns np np' nd nf 子n21 (n-1)s (-1)p (n-1)d (n-1)f ns 0.30 0.25 0.23 0.00 0.00 ns 1.00 0.90 0.93 0.86 np 0.35 0.31 0.29 0.00 0.00 np 1.00 0.97 0.98 0.90 np' 0.41 0.37 0.31 0.00 0.00 np' 1.00 1.00 1.00 0.94 nd 1.00 1.00 1.00 0.35 0.00 nd 1.00 1.00 1.00 1.00 nf 1.00 1.00 1.00 1.00 0.39 *1s对2s的c=0.85。 ●主量子数等于(n一1)的各电子,其o由表1.2求。 ●主量子数等于或小于(m一2)的各电子,其σ=1.00
徐光宪改进的Slater屏蔽常数规则 主量子数大于n的各电子,其=0; 主量子数等于n的各电子,其由表1.1求。其中np指半充满前 的p电子, np’ 指半充满后的p电子(即第4、第5、第6个p电子); 表1.1 n层对n层的屏蔽常数 表1.2 (n-1)层对n层的屏蔽常数 主量子数等于(n-1)的各电子,其由表1.2求。 主量子数等于或小于(n-2)的各电子,其=1.00。 被屏蔽电子 n≥1 屏蔽电子 ns np np’ nd nf ns 0.30 0.25 0.23 0.00 0.00 np 0.35 0.31 0.29 0.00 0.00 np’ 0.41 0.37 0.31 0.00 0.00 nd 1.00 1.00 1.00 0.35 0.00 nf 1.00 1.00 1.00 1.00 0.39 被屏蔽电 子n≥1 屏蔽电子 (n-1)s (n-1)p (n-1)d (n-1)f ns 1.00 0.90 0.93 0.86 np 1.00 0.97 0.98 0.90 np’ 1.00 1.00 1.00 0.94 nd 1.00 1.00 1.00 1.00 * 1s对2s的σ=0.85

(2)电负性 电负性义表示原子形成正负离子的倾向或化合物 中原子对成键电子吸引能力的相对大小(并非单独原 子的性质,受分子中所处环境的影响)。有多种不同定 义方法,定量标度也各不相同
电负性 表示原子形成正负离子的倾向或化合物 中原子对成键电子吸引能力的相对大小(并非单独原 子的性质, 受分子中所处环境的影响)。有多种不同定 义方法,定量标度也各不相同。 (2) 电负性

①原子的杂化状态 原子的杂化状态对电负性的影响是因为s电子的钻 穿效应比较强,s轨道的能量比较低,有较大的吸引 电子的能力。所以杂化轨道中含s成分越多,原子的 电负性也就越大。例如,碳和氮原子在杂化轨道s3、 sp和sp中s成分分别为25%、33%、50%,相应的电 负性分别为2.48、2.75、3.29和3.08、3.94、4.67。 一般所取碳的电负性为2.55,氮为3.04,分别相 当于sp3杂化轨道的电负性。当以sp杂化时,碳的电负 性值约接近于氧3.44),氮的电负性甚至比氟3.98)还 要大
① 原子的杂化状态 原子的杂化状态对电负性的影响是因为s电子的钻 穿效应比较强,s轨道的能量比较低,有较大的吸引 电子的能力。所以杂化轨道中含s成分越多,原子的 电负性也就越大。例如,碳和氮原子在杂化轨道sp3 、 sp2和sp中s成分分别为25%、33%、50%,相应的电 负性分别为2.48、2.75、3.29和3.08、3.94、4.67。 一般所取碳的电负性为2.55,氮为3.04,分别相 当于sp3杂化轨道的电负性。当以sp杂化时,碳的电负 性值约接近于氧(3.44),氮的电负性甚至比氟(3.98)还 要大
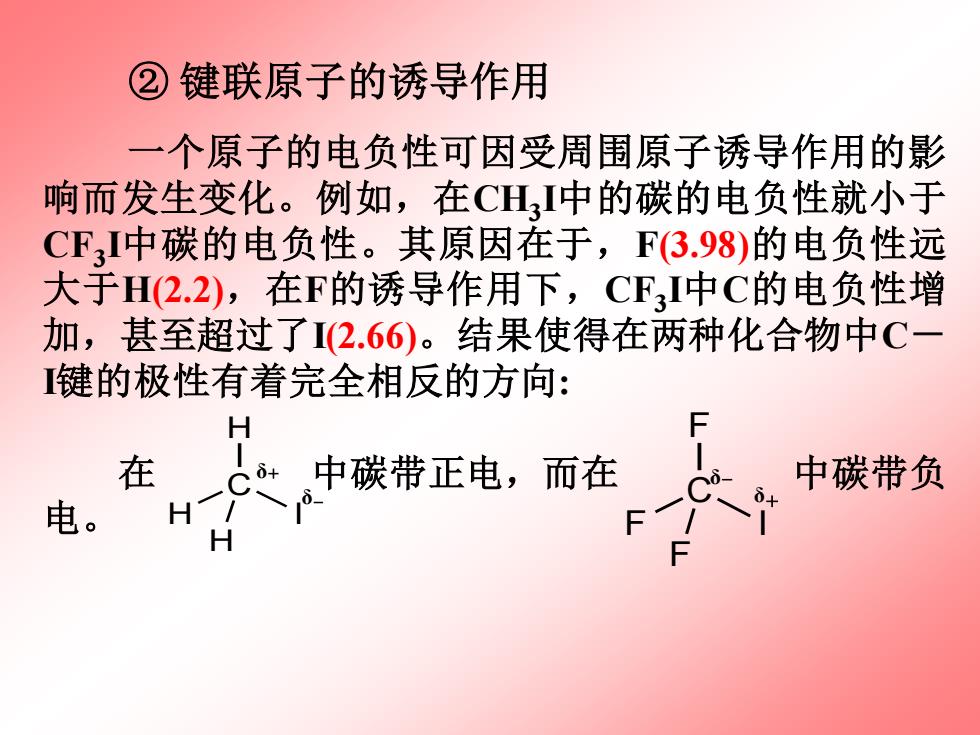
②键联原子的诱导作用 一个原子的电负性可因受周围原子诱导作用的影 响而发生变化。例如,在CHI中的碳的电负性就小于 CF,I中碳的电负性。其原因在于,F3.98)的电负性远 大于H(2.2),在F的诱导作用下,CF3I中C的电负性增 加,甚至超过了I(2.66)。结果使得在两种化合物中C一 键的极性有着完全相反的方向: H 在 C+ 中碳带正电,而在 中碳带负 电。 H
② 键联原子的诱导作用 一个原子的电负性可因受周围原子诱导作用的影 响而发生变化。例如,在CH3 I中的碳的电负性就小于 CF3 I中碳的电负性。其原因在于,F(3.98)的电负性远 大于H(2.2),在F的诱导作用下,CF3 I中C的电负性增 加,甚至超过了I(2.66)。结果使得在两种化合物中C- I键的极性有着完全相反的方向: 在 中碳带正电,而在 中碳带负 电。 H C H I H δ+ δ- F C F I F δ+ δ-
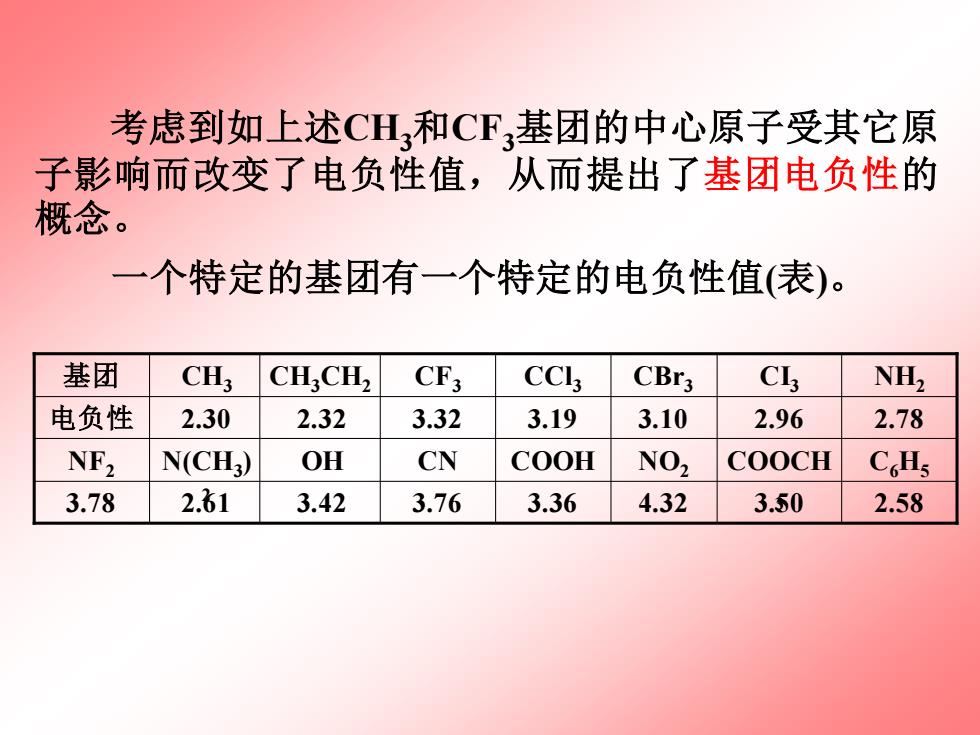
考虑到如上述CH,和CF,基团的中心原子受其它原 子影响而改变了电负性值,从而提出了基团电负性的 概念。 一个特定的基团有一个特定的电负性值(表)。 基团 CH; CHCH2 CF3 CCl CBr3 C NH2 电负性 2.30 2.32 3.32 3.19 3.10 2.96 2.78 NF2 N(CH) OH CN COOH NO2 COOCH C.Hs 3.78 2.61 3.42 3.76 3.36 4.32 3.50 2.58
考虑到如上述CH3和CF3基团的中心原子受其它原 子影响而改变了电负性值,从而提出了基团电负性的 概念。 一个特定的基团有一个特定的电负性值(表)。 3.78 2.61 3.42 3.76 3.36 4.32 3.50 2.58 COOCH C6H5 3 N(CH3 OH CN COOH NO2 ) 2 NF2 电负性 2.30 2.32 3.32 3.19 3.10 2.96 2.78 基团 CH3 CH3CH2 CF3 CCl3 CBr3 CI3 NH2

③原子所带电荷 电负性与电荷的关系可用式y=a十bδ表示。 式中δ为分子中原子所带的部分电荷。a、b为两 个参数。其意义是:a表示中性原子的电负性(中性 原子δ=0),b为电荷参数,表示电负性随电荷而改 变的变化率。大的、易极化的原子有较小的b值; 小的、难以极化的原子b值较大
③ 原子所带电荷 电负性与电荷的关系可用式χ=a+b表示。 式中为分子中原子所带的部分电荷。a、b为两 个参数。其意义是: a表示中性原子的电负性(中性 原子=0), b为电荷参数,表示电负性随电荷而改 变的变化率。大的、易极化的原子有较小的b值; 小的、难以极化的原子b值较大
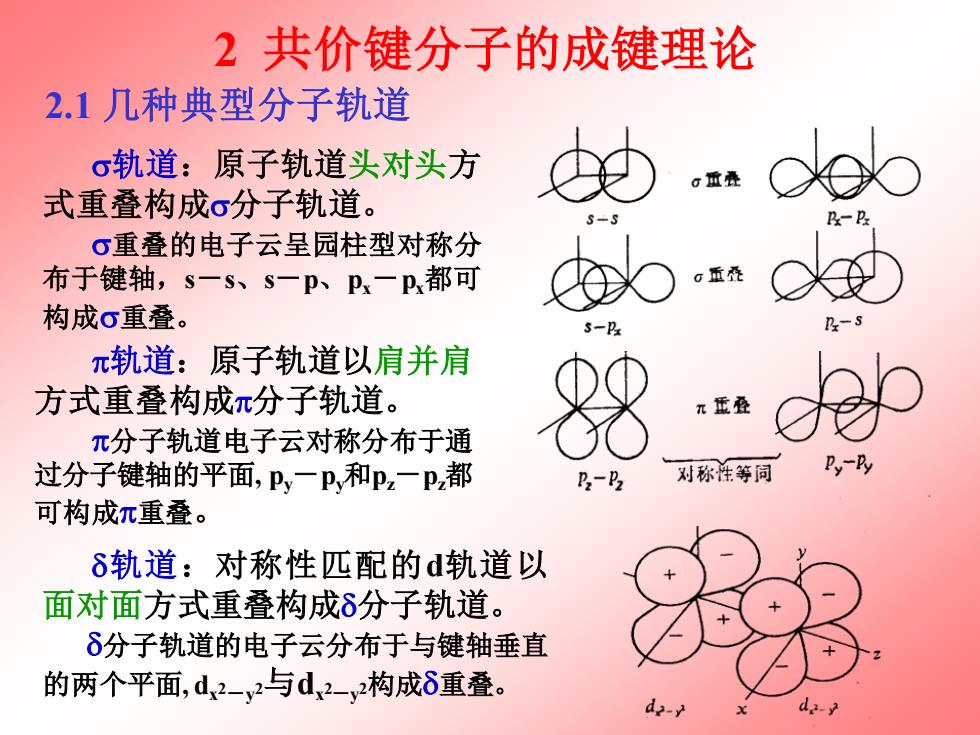
2共价键分子的成键理论 2.1几种典型分子轨道 σ轨道:原子轨道头对头方 重叠 式重叠构成o分子轨道。 长斗 σ重叠的电子云呈园柱型对称分 布于键轴,s一S、S一p、Px一P,都可 重叠 构成σ重叠。 5 π轨道:原子轨道以肩并肩 方式重叠构成π分子轨道。 π亚叠 π分子轨道电子云对称分布于通 过分子键轴的平面,P,一P和pz一P都 P2-P2 对称性等同 可构成π重叠。 δ轨道:对称性匹配的d轨道以 面对面方式重叠构成δ分子轨道。 δ分子轨道的电子云分布于与键轴垂直 的两个平面,d2-v2与d2-y2构成δ重叠
2 共价键分子的成键理论 2.1 几种典型分子轨道 轨道:原子轨道头对头方 式重叠构成分子轨道。 重叠的电子云呈园柱型对称分 布于键轴,s-s、s-p、px-px都可 构成重叠。 轨道:原子轨道以肩并肩 方式重叠构成分子轨道。 分子轨道电子云对称分布于通 过分子键轴的平面, py-py和pz-pz都 可构成重叠。 轨道:对称性匹配的d轨道以 面对面方式重叠构成分子轨道。 分子轨道的电子云分布于与键轴垂直 的两个平面, dx 2-y 2与dx 2-y 2构成重叠