
热力学稳定性和反应的自发性 一热力学稳定性和动力学稳定性 无机化学中讨论元素及化合物的性质时,其中一个中心问题 就是化学体系的稳定性。 如,某元素能否形成某种化合物,这要看该化合物能否在一 定条件下稳定存在。在研究一个合成反应是否可行时,也可把问 题归结为有关反应物体系是否稳定。因而可以说,无机化学里的 一个重要问题是试图去说明不同化学体系的稳定性。 一 般地说,一个体系是稳定的,即表观上不随时间而变化。 物理化学上把稳定的体系划分为两类,一类是真正稳定的,另 类是表观稳定的。前者是体系处于平衡状态,在该条件下体系中 的各种可能变化都不能自发进行。如CaCO,在常温下既不能分解 为CaO和C0,也不能分解为C、O,和Ca单质。另一种不是处于平衡 状态,而只是表观上稳定,即至少有一种可能的变化会自发进行, 只是变化的速率十分缓慢,以致不可能测量出来。如H,、O,的混 食入凳车室得景赛型a路长&小o智一释碧 性是由热力学因素所控制,称为热力学稳定性;,后一种稳定性是 由动力学因素 速率所控制,称为动力学稳定性
热力学稳定性和反应的自发性 一 热力学稳定性和动力学稳定性 无机化学中讨论元素及化合物的性质时,其中一个中心问题 就是化学体系的稳定性。 如,某元素能否形成某种化合物,这要看该化合物能否在一 定条件下稳定存在。在研究一个合成反应是否可行时,也可把问 题归结为有关反应物体系是否稳定。因而可以说,无机化学里的 一个重要问题是试图去说明不同化学体系的稳定性。 一般地说,一个体系是稳定的,即表观上不随时间而变化。 物理化学上把稳定的体系划分为两类,一类是真正稳定的,另一 类是表观稳定的。前者是体系处于平衡状态,在该条件下体系中 的各种可能变化都不能自发进行。如CaCO3在常温下既不能分解 为CaO和CO2 ,也不能分解为C、O2和Ca单质。另一种不是处于平衡 状态,而只是表观上稳定,即至少有一种可能的变化会自发进行, 只是变化的速率十分缓慢,以致不可能测量出来。如H2、O2的混 合气体在室温下是稳定的,可以长久共存。然而一旦将一块铂箔 放入其中,立即就会发生猛烈的反应,化合成H2O。前一种稳定 性是由热力学因素所控制,称为热力学稳定性;后一种稳定性是 由动力学因素——速率所控制,称为动力学稳定性

对任一个化学反应,其稳定性可由反应的平衡常数来判断。 如果平衡常数K值很小,则反应只要生成极少量产物就达到了平衡 态(此时反应物和产物的量不再变化),反应物的量接近于原始量, 此时,我们认为该反应物是稳定的。反之,K值很大,达到平衡时, 反应物几乎完全转变成了产物,那么反应物当然是不稳定的。 平衡常数K与反应的标准自由焓变化△G有如下关系式: △G=-RTInK 因此,△G的大的正值,意味着非常小的平衡常数,对于产 物的生成来说,反应物是热力学稳定的,因为达到平衡时,仅有 非常少量的产物生成。相反,△Gm大的负值意味着大的平衡常数, 这样一来,必须消耗相当量的反应物去生成产物才能达到平衡, 所以反应物是不稳定的。若△G=0,K=1,意味着体系处于一种 特定的状态,反应物和产物的量都不再随时间而改变。 一个反应的△Gm可通过以下关系式求得。 已知AL和△,Sm,△,G。=△H-TA,Sm9 已知各物种的△Gm9△,Gm=∑n△Gm(产)一∑n,△Gm(反) m 已知标准电动势,△,Gm9=一nl
对任一个化学反应,其稳定性可由反应的平衡常数来判断。 如果平衡常数K值很小,则反应只要生成极少量产物就达到了平衡 态(此时反应物和产物的量不再变化),反应物的量接近于原始量, 此时,我们认为该反应物是稳定的。反之,K值很大,达到平衡时, 反应物几乎完全转变成了产物,那么反应物当然是不稳定的。 平衡常数K与反应的标准自由焓变化△rGm θ有如下关系式: △rGm θ=-RTlnK 因此,△rGm θ的大的正值,意味着非常小的平衡常数,对于产 物的生成来说,反应物是热力学稳定的,因为达到平衡时,仅有 非常少量的产物生成。相反,△rGm θ大的负值意味着大的平衡常数, 这样一来,必须消耗相当量的反应物去生成产物才能达到平衡, 所以反应物是不稳定的。若△Gθ=0,K=1,意味着体系处于一种 特定的状态,反应物和产物的量都不再随时间而改变。 一个反应的△rGm θ可通过以下关系式求得。 已知△rHm θ和△rSm θ , △rGm θ=△rHm θ-T△rSm θ 已知各物种的△fGm θ , △rGm θ=∑nj△fGm θ (产)-∑ni△fGm θ (反) 已知标准电动势,△rGm θ=-nFEθ

可见用△G来判断一个反应体系的稳定性与用K来判断是 回事。 严格地说必须用△G来进行判断,原因是△G所指的反应 物和生成物都处于标准态,或虽不是标准态,但反应熵Q=1这样 的特定条件下的自由焓变化值,而在实际情况是,反应物和产 物都未必都是处于这种状态。 但是根据等温式△Gnm=△Gm+RTlnQ,如果△G的绝对 值十分大,则△Gm的正负号就基本上决定了△Gn的符号。即, 若△Gm的负值很大,一般情况下,△Gm大致也是负值,要使 △G改变符号就必须使Q变得很大,这在实际上有时是难以办 到的。如在298K时,反应 Zn(s)+1/2O2(g)=Zn0(s) △,Gm9=-318.3 kJ.mol-1 根据△,Gn=-RTlnK,K=[1/{p(O2)/P]2, 解出p(02)=2.82×10-107Pa。 即要使此反应不能正向进行,则应使Q>K,即要使(O,)如此 地低,这是难以办到的,在通常情况下,p(O)总是大于这个值 *△,Gm只决定于反应的始态和终态,即热力学稳定性与反应途 径或机理无关
可见用△rGm θ*来判断一个反应体系的稳定性与用K来判断是 一回事。 严格地说必须用△G来进行判断,原因是△rGm θ所指的反应 物和生成物都处于标准态, 或虽不是标准态, 但反应熵Q=1这样 的特定条件下的自由焓变化值,而在实际情况是,反应物和产 物都未必都是处于这种状态。 但是根据等温式△rGm =△rGm θ+RTlnQ,如果△rGm θ的绝对 值十分大,则△rGm θ的正负号就基本上决定了△rGm的符号。即, 若△rGm θ的负值很大,一般情况下,△rGm大致也是负值,要使 △rGm改变符号就必须使Q变得很大,这在实际上有时是难以办 到的。如在298K时,反应 Zn(s)+1/2 O2 (g)=ZnO(s) △rGm θ=-318.3 kJ·mol-1 根据 △rGm θ=-RTlnKθ ,K=[1/{p(O2 ) /Pθ}]1/2 , 解出 p(O2 )=2.82×10-107 Pa。 即要使此反应不能正向进行, 则应使Q>K, 即要使p(O2 )如此 地低,这是难以办到的,在通常情况下,p(O2 ) 总是大于这个值。 *△rGm θ只决定于反应的始态和终态,即热力学稳定性与反应途 径或机理无关

同理,如果△Gm的正值很大,也很难通过改变Q的数值使 △Gn的符号与△Gn相反。 因此,当△G的绝对值很大时,可以用△G的值来判断 反应的方向。 习惯上人们把△Gm40 kJ.moli-1分别作为 反应可能是自发和不可能是自发进行,或反应物是不稳定的或稳 定的判断依据。如果-40<△,G<40,就存在可能通过改变Q值 时平衡向所需方向进行的可能性。 如在298K时,反应NH,Cl(s)一NH,(g)+HCl(g)△G=92.3 kJ.mol-1。认为在这时NH,CI是不能自发分解的或NH,CI是稳定的。 但是,对于NH,HCO,(s)一→NH3+HO(g)+CO2,△G=31.1 kJ.mol-1,处于-40和40之间,假定pNH3)=pH2O)=p(C02)= 1.01325×105Pa时,NH,HCO3在室温下不分解;但是若改变这三 者的压力,如分别变为0.01×1.01325×105Pa,则 △G=△G+RTInQ 0.01×1.01325×1053 =31.1+8.315×10-3×298×1n 1.01325×105 =-3.1 kJ.mol-1<0。 所以在此条件下,NH,HCO,就可以分解了
同理,如果△rGm θ的正值很大,也很难通过改变Q的数值使 △rGm的符号与△rGm θ相反。 因此,当△rGm θ的绝对值很大时,可以用△rGm θ的值来判断 反应的方向。 习惯上人们把△rGm θ40 kJ·mol-1分别作为 反应可能是自发和不可能是自发进行,或反应物是不稳定的或稳 定的判断依据。如果-40<△rGm θ<40,就存在可能通过改变Q值 时平衡向所需方向进行的可能性。 如在298K时,反应 NH4Cl(s) NH3 (g)+HCl(g) △Gθ=92.3 kJ·mol-1 。认为在这时NH4Cl是不能自发分解的或NH4Cl是稳定的。 但是,对于NH4HCO3 (s) NH3+H2O(g)+CO2 , △Gθ=31.1 kJ·mol-1 ,处于-40和40之间,假定p(NH3 )=p(H2O)=p(CO2 )= 1.01325×105Pa时,NH4HCO3在室温下不分解;但是若改变这三 者的压力,如分别变为0.01×1.01325×105Pa,则 △G=△Gθ+RTlnQ =31.1+8.315×10-3×298×ln =-3.1 kJ·mol-1 <0。 所以在此条件下,NH4HCO3就可以分解了。 0.01×1.01325×105 1.01325×105 3
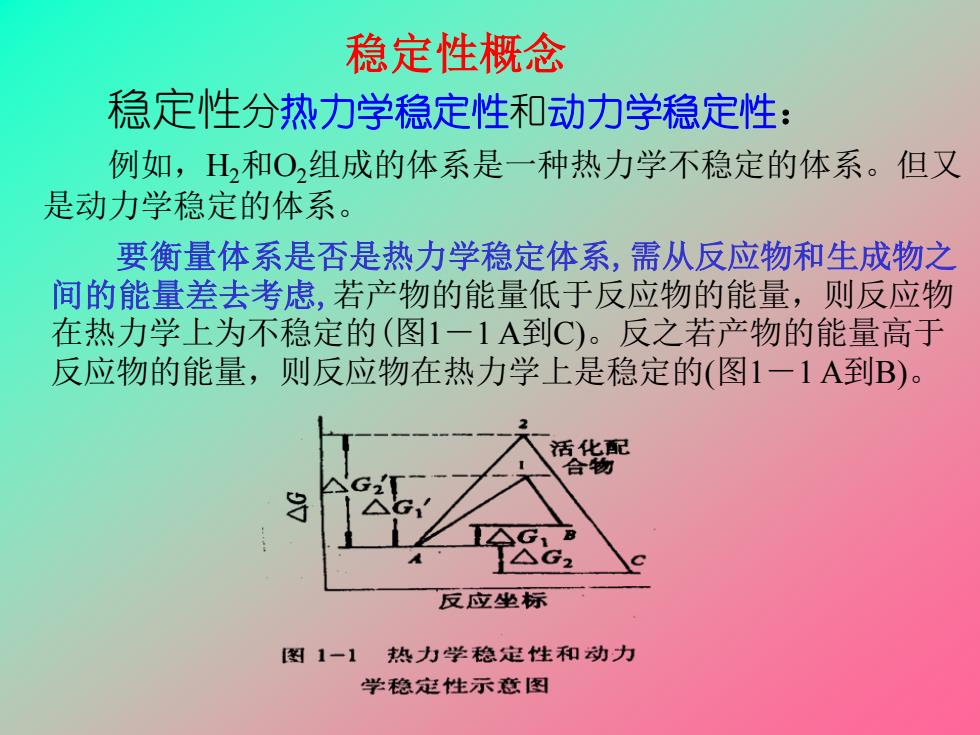
稳定性概念 稳定性分热力学稳定性和动力学稳定性: 例如,H和O组成的体系是一种热力学不稳定的体系。但又 是动力学稳定的体系。 要衡量体系是否是热力学稳定体系,需从反应物和生成物之 间的能量差去考虑,若产物的能量低于反应物的能量,则反应物 在热力学上为不稳定的(图1一1A到C)。反之若产物的能量高于 反应物的能量,则反应物在热力学上是稳定的(图1一1A到B)。 活化配 合物 反应坐标 图1-1 热力学稳定性和动力 学稳定性示意图
要衡量体系是否是热力学稳定体系,需从反应物和生成物之 间的能量差去考虑,若产物的能量低于反应物的能量,则反应物 在热力学上为不稳定的(图1-1 A到C)。反之若产物的能量高于 反应物的能量,则反应物在热力学上是稳定的(图1-1 A到B)。 稳定性分热力学稳定性和动力学稳定性: 例如,H2和O2组成的体系是一种热力学不稳定的体系。但又 是动力学稳定的体系。 稳定性概念
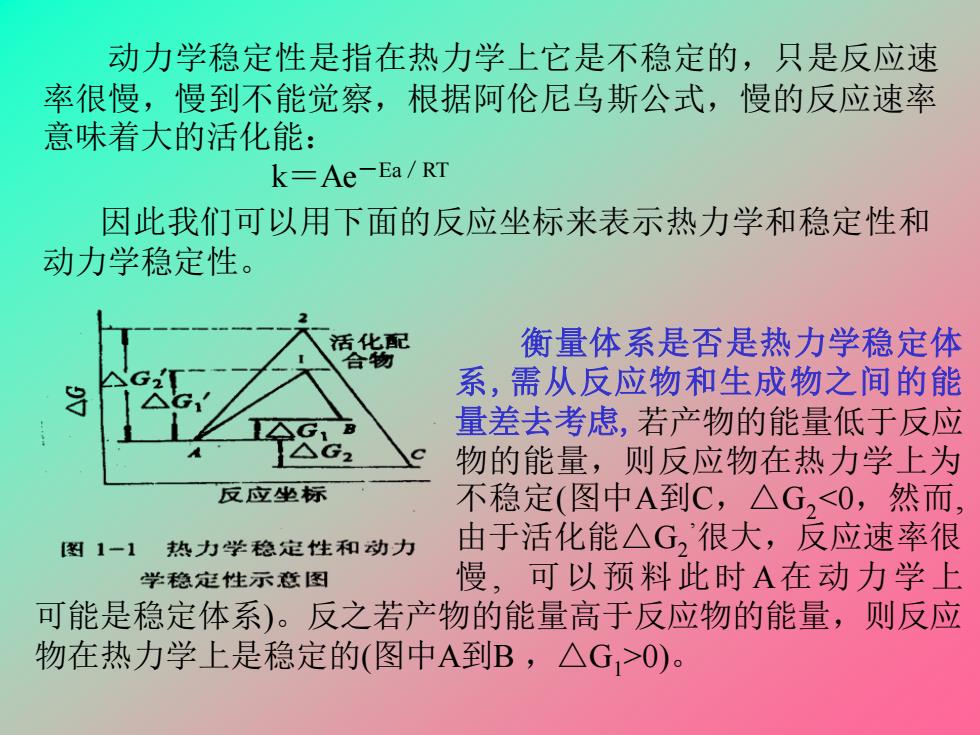
动力学稳定性是指在热力学上它是不稳定的,只是反应速 率很慢,慢到不能觉察,根据阿伦尼乌斯公式,慢的反应速率 意味着大的活化能: k=Ae-Ea/RT 因此我们可以用下面的反应坐标来表示热力学和稳定性和 动力学稳定性。 活化配 衡量体系是否是热力学稳定体 合物 系,需从反应物和生成物之间的能 量差去考虑,若产物的能量低于反应 物的能量,则反应物在热力学上为 反应坐标 不稳定(图中A到C,△G,0)
动力学稳定性是指在热力学上它是不稳定的,只是反应速 率很慢,慢到不能觉察,根据阿伦尼乌斯公式,慢的反应速率 意味着大的活化能: k=Ae-Ea/RT 衡量体系是否是热力学稳定体 系,需从反应物和生成物之间的能 量差去考虑,若产物的能量低于反应 物的能量,则反应物在热力学上为 不稳定(图中A到C,△G20)。 因此我们可以用下面的反应坐标来表示热力学和稳定性和 动力学稳定性

动力学稳定性是从反应物与活化配合物之间的能量差,即反 应活化能来考虑的,若某一反应物转变为产物的趋势很大,反应 物在热力学上相当不稳定,但若实现这一反应所需的活化能也相 当大的话,则在动力学上反应物又是相当稳定的了。 在下面的图中,反应的自由焓变表明由A→B和由A→C都 是热力学不稳定体系,由于生成物C的能量更低,按理,从热力学 角度考虑将有利于反应A→C的进行,但是由于A→C的活化自由 能大于由A一B的活化自由能,所以从动力学角度考虑,将有利于 生成B。倘若△G,相当大,则完全有可能只生成B而不生成C。 热力学稳定性和动力学稳 活化配 合物 定性之间没有必然的联系。 催化剂可以改变反应的历程,亦即能改 变反应的活化能,因此,催化剂阿以增加或 降低动力学稳定性,但催化剂不能改变热 反应坐标 力学的稳定性或不稳定性。因为催化剂并 不改变反应的始态和终态,换言之,热力 图1-2 由动力学控制的热 学指出不能自发进行的反应是不能通过使 力学不稳定体系 用催化剂而使其发生的
动力学稳定性是从反应物与活化配合物之间的能量差,即反 应活化能来考虑的,若某一反应物转变为产物的趋势很大,反应 物在热力学上相当不稳定,但若实现这一反应所需的活化能也相 当大的话, 则在动力学上反应物又是相当稳定的了。 在下面的图中,反应的自由焓变表明由A B和由A C都 是热力学不稳定体系,由于生成物C的能量更低, 按理, 从热力学 角度考虑将有利于反应A C的进行, 但是由于A C的活化自由 能大于由A B的活化自由能, 所以从动力学角度考虑, 将有利于 生成B。倘若△G2 ’相当大,则完全有可能只生成B而不生成C。 热力学稳定性和动力学稳 定性之间没有必然的联系。 催化剂可以改变反应的历程,亦即能改 变反应的活化能,因此,催化剂可以增加或 降低动力学稳定性, 但催化剂不能改变热 力学的稳定性或不稳定性。因为催化剂并 不改变反应的始态和终态,换言之,热力 学指出不能自发进行的反应是不能通过使 用催化剂而使其发生的

般地,关于物质的稳定性,不外乎其本身是否容易分解, 该物质能否与环境中的某物种发生化学反应。所以在讨论物质的 稳定性时, 首先要列出该物质的所有可能的分解反应。如分解成单质、 分解成简单化合物、化合物的歧化: 其次还要考虑该物质是否能与大气中常见组分发生化学变化。 最后, 由各物质的标准生成自由焓算出一切可能的化学反应 的自由焓变。 与大气中组分的反应 物质 分解成单质 分解成简单化合物 △G=? 歧化 如果所有的可能反应的△G>O,就说该物质是稳定的;如果 有一个或多于1个反应的△G<0,即该物质对该反应是自发的,因 而该物质是不稳定的
一般地,关于物质的稳定性,不外乎其本身是否容易分解, 该物质能否与环境中的某物种发生化学反应。所以在讨论物质的 稳定性时, 首先要列出该物质的所有可能的分解反应。如分解成单质、 分解成简单化合物、化合物的歧化; 其次还要考虑该物质是否能与大气中常见组分发生化学变化。 最后,由各物质的标准生成自由焓算出一切可能的化学反应 的自由焓变。 如果所有的可能反应的△G>0,就说该物质是稳定的;如果 有一个或多于1个反应的△G< 0,即该物质对该反应是自发的,因 而该物质是不稳定的。 △G=? 与大气中组分的反应 分解成单质 分解成简单化合物 歧化 物质

如:讨论H,S的稳定性。 先查出它的△Gm=一34 kJmol-1 即H,S(g)=H,(g)+S(s)△Gn=34 kJ.mol-1 说明,S对于分解成单质来说是稳定的。 此处的标准生成自由焓,常常可以用来作为无机物相对于单 质的稳定性量度。如果△G<0,意味着由指定单质生成该物种 能量降低,生成反应是自发的,其逆反应的△G0,即分解为单 质是非自发的。这样,△G负值越大,化合物对于分解成单质稳 定性就越大。 不过在上述讨论中都是指的标准状态,然而 ①由于大气中的H,很少,其分压远小于1.01325×10Pa,且 △G的绝对值小于40,意指可以通过改变Q值而达到改变反应方 向。事实上,空气中H,的实际浓度为0.01%(V),计算得到的 △Gm≈21 kJmol-1,说明H,S在大气中对分解为单质是稳定的。 ②考虑H,S能与大气中的O,反应 HS+1/20,=H,O+S △G=-203.62<<-40kJmo- 所以对HS的稳定性的描述可以是这样: H,$在常温下大气中对于分解为单质是稳定的,但它能同氧发 生反应,所以H,S在大气中对氧化反应是不稳定的
如:讨论H2 S的稳定性。 先查出它的△fGm θ=-34 kJ·mol-1 即 H2 S (g)=H2 (g)+S(s) △rGm θ=34 kJ·mol-1 说明H2 S对于分解成单质来说是稳定的。 此处的标准生成自由焓,常常可以用来作为无机物相对于单 质的稳定性量度。如果△fGm θ0,即分解为单 质是非自发的。这样, △fGm θ负值越大, 化合物对于分解成单质稳 定性就越大。 不过在上述讨论中都是指的标准状态,然而 ① 由于大气中的H2很少,其分压远小于1.01325×105Pa,且 △Gθ的绝对值小于40,意指可以通过改变Q值而达到改变反应方 向。事实上,空气中H2的实际浓度为0.01%(V),计算得到的 △rGm ≈ 21 kJ·mol-1 ,说明H2 S在大气中对分解为单质是稳定的。 ② 考虑H2 S能与大气中的O2反应 H2 S+1/2O2 =H2O+S △Gθ=-203.62 <<-40 kJ·mol-1 所以对H2 S的稳定性的描述可以是这样: H2 S在常温下大气中对于分解为单质是稳定的,但它能同氧发 生反应,所以H2 S在大气中对氧化反应是不稳定的

二吉布斯自由能变化与金属的还原 在无机化学中,认识金属氧化物、卤化物、硫化物的还原反应的规律十 分重要,而这种规律可以通过对还原反应进行热力学分析得到。 1氧化物的生成焓和还原反应的方向 不同的氧化物有不同的生成焓,为了能用热力学数据比较不 同氧化物的稳定性,首要的应消除不同价态造成的差别,习惯上 常按折合成消耗1molO,所形成的氧化物的生成焓进行比较,即: M+0,-3N0, △Hm(MO,) 如 3A1+02=3,0 △Hm(20,)=-1118 kJ-mol- 2Mh+02=2Mn,04 A H(MnO)=-694 kJ.mol-1
二 吉布斯自由能变化与金属的还原 在无机化学中,认识金属氧化物、卤化物、硫化物的还原反应的规律十 分重要,而这种规律可以通过对还原反应进行热力学分析得到。 1 氧化物的生成焓和还原反应的方向 不同的氧化物有不同的生成焓,为了能用热力学数据比较不 同氧化物的稳定性,首要的应消除不同价态造成的差别,习惯上 常按折合成消耗1mol O2所形成的氧化物的生成焓进行比较,即: M+O2 = MxOy △fHm θ ( MxOy ) 如 Al+O2 = Al2O3 △fHm θ ( Al2O3 )=-1118 kJ·mol-1 Mn+O2 = Mn3O4 △fHm θ ( Mn3O4 )=-694 kJ·mol-1 2x y 2 y 2 y 2 3 2 3 4 3 1 2 3 2 1 2