
配合物隐定性的热力学对论 焓变与熵变对配位反应吉布斯自由能变的贡献 以前讲过,任何反应都可通过吉布斯自由能变来判断反应的 方向,已知△G=△H一T△S,△G的符号和大小取决于焓效应 和熵效应两项的相对大小。在配位反应中,其吉布斯自由能变 有时主要由焓变△H所决定,有时又需同时兼顾△H和△S的影 响,有时则可能完全是由△S起主导作用。以下列反应为例: CeCIO2+(aq)+SO2-(aq)=CeSO(aq)+CIO(aq) ∑△Gm9 -11 -19 △Gm9=-8 ∑△Hm9 -49 20 △Hm6=69 ∑Sm9 -130 130 △rSm9=260 ∑T△rSm9 -38.8 38.8 △(T△Sm)=77.6
配合物稳定性的热力学讨论 一 焓变与熵变对配位反应吉布斯自由能变的贡献 以前讲过,任何反应都可通过吉布斯自由能变来判断反应的 方向,已知△G=△H-T△S, △G的符号和大小取决于焓效应 和熵效应两项的相对大小。在配位反应中,其吉布斯自由能变 有时主要由焓变△H所决定,有时又需同时兼顾△H和△S的影 响,有时则可能完全是由△S起主导作用。以下列反应为例: CeClO4 2+(aq)+SO4 2-(aq)=CeSO4 +(aq)+ClO4 -(aq) ∑△fGm θ -11 -19 △rGm θ=-8 ∑△fHm θ -49 20 △rHm θ=69 ∑Sm θ -130 130 △r Sm θ=260 ∑T△r Sm θ -38.8 38.8 △(T△r Sm θ )=77.6

由上列数据可见,如只用△Hn代替△G,则△H= 69,反应似乎是向左进行;但实际上反应的△G=一8 kJol-l,表明反应向右进行。可见,由△Hm去判断反应的 方向得到了错误的结果。这是因为反应的熵变△S数值很大, △Sm9=260JK-lmol-l,T△Sm项改变了77.6 kJmol-l,熵 效应项的影响超过了焓效应项的影响。 上述结果说明,SO,2-是比CIO,一强的配位剂
由上列数据可见,如只用△rHm θ代替△rGm θ ,则△rHm θ= 69,反应似乎是向左进行;但实际上反应的△rGm θ=-8 kJ·mol-1 ,表明反应向右进行。可见,由△rHm θ去判断反应的 方向得到了错误的结果。这是因为反应的熵变△rSm θ数值很大, △rSm θ=260 J·K-1·mol-1 ,T△rSm θ项改变了77.6 kJ·mol-1 ,熵 效应项的影响超过了焓效应项的影响。 上述结果说明,SO4 2-是比ClO4 -强的配位剂

为什么SO,2-是比C1O-强的配位剂呢?根据离子熵的经验 公式,单原子水合离子的熵为: S0= c(z+3)2 InAr+RInQ-(+256.8 JK-1-mol- 式中c=3284pmJK-1mol-1;x,对正离子取120,负离子 取40:Q是电子的基态多重性,A相对原子质量,z离子电荷,r 六配位离子的半径。 将$0,2-和C1O,(均为四面体结构)看作单原子负离子,则 根据上式,离子半径越小,电荷越高,其熵值越小。因此,高价 相反电荷离子间相互作用释放出低价的离子,而低价离子的熵值 大,因而此过程就产生了正的较大的熵变。 如Ce3+与S0,2-结合释放出CIO,-产生38.8 kJmol-1的熵效 应贡献。若是相反,由低价离子置换高价离子将产生不利的熵效 应。 再者,CO一体积大,相应熵值就大,要参与配位也会产生不利 的熵变,所以,C1O4一还有NO3一它们的配位能力都比较微弱。 鉴于这种特性,常用它们作为金属离子的惰性载体
为什么SO4 2-是比ClO4 -强的配位剂呢?根据离子熵的经验 公式,单原子水合离子的熵为: S θ= RlnAr+RlnQ-( )+256.8 J·K-1·mol-1 式中 c=3284 pm·J·K-1·mol-1;x,对正离子取120,负离子 取40;Q是电子的基态多重性,Ar相对原子质量,z离子电荷,r 六配位离子的半径。 将SO4 2-和ClO4 -(均为四面体结构)看作单原子负离子,则 根据上式,离子半径越小,电荷越高,其熵值越小。因此,高价 相反电荷离子间相互作用释放出低价的离子,而低价离子的熵值 大,因而此过程就产生了正的较大的熵变。 如Ce3+与SO4 2-结合释放出ClO4 -产生38.8 kJ·mol-1的熵效 应贡献。若是相反,由低价离子置换高价离子将产生不利的熵效 应。 再者,ClO4 -体积大,相应熵值就大,要参与配位也会产生不利 的熵变,所以,ClO4 --还有NO3 --它们的配位能力都比较微弱。 鉴于这种特性,常用它们作为金属离子的惰性载体。 3 2 c(|z|+3)2 r+x

二螯合效应是有利熵效应的反映 Ni(H2O)2+(aq)+6NH3(aq)-Ni(NH)2+(aq)+6H2O(I) Ni(H2O)2+(aq)+3en(aq)-Ni(en)32+(aq)+6H2O(I) 在第一个反应中,溶液中不形成螯合离子,这时,每一配位 体取代水合配离子中的一个水分子,取代前后溶液中的质点数不 变。在第二个反应中,每一个乙二胺配位体取代水分子配离子中 的两个水分子,取代后溶液中质点数增加,所以第二个反应比第 个反应的熵变值要大,因而使得螯合配离子Ni(en),2+比非螯合 配离子NNH)2+要稳定。所以可以这样说,螯合效应起因于熵 效应的贡献。 在EDTA作为配位体的反应中,由于①螯合效应和②部分中 和电荷的综合影响,使得反应的熵变更大。EDTA有六个配位原 子[(OOCCH2)2NCH,CH,N(CH,COO-)2],一般地,由这种配位 体所形成的配合物的稳定性都很高,其原因就是有很大的熵变之 故
二 螯合效应是有利熵效应的反映 Ni(H2O)6 2+(aq)+6NH3 (aq) Ni(NH3 ) 6 2+(aq)+6H2O(l) Ni(H2O)6 2+(aq)+3en(aq) Ni(en)3 2+(aq)+6H2O(l) 在第一个反应中,溶液中不形成螯合离子,这时,每一配位 体取代水合配离子中的一个水分子,取代前后溶液中的质点数不 变。在第二个反应中,每一个乙二胺配位体取代水分子配离子中 的两个水分子,取代后溶液中质点数增加,所以第二个反应比第 一个反应的熵变值要大,因而使得螯合配离子Ni(en)3 2+比非螯合 配离子Ni(NH3 ) 6 2+要稳定。所以可以这样说,螯合效应起因于熵 效应的贡献。 在EDTA作为配位体的反应中,由于① 螯合效应和② 部分中 和电荷的综合影响,使得反应的熵变更大。EDTA有六个配位原 子[(OOCCH2 -) 2NCH2CH2N(CH2COO-) 2 ],一般地,由这种配位 体所形成的配合物的稳定性都很高,其原因就是有很大的熵变之 故

三配位场稳定化能对过渡元素配合物稳定性的影响 众所周知,配位场理论的核心是配位体的静电场与中心离子 的作用所引起的d轨道的分裂和d电子进入低能轨道带来的稳定化 能使体系能量下降,从而产生一种附加的成键作用效应。这种附 加的成键作用效应及其大小理所当然地会在配合物的热化学性质 上表现出来。 以具有d组态的过渡金属离子的水合焓为例。 Mm+(g)+6HO=[M(HO)(aq)AmH(Mm+,tN2geg-N) 显然水合焓与中心离子的d轨道处于配体H,O的静电场有关 假定这种静电场由球形对称的静电场和正八面体对称的静电场两 部分所组成,基于此,可以写出玻恩一哈伯热化学循环。 Mt(d,g+6H,0 M思MH,O,小m+(aq)(Lc,-y -6△,Hme(Mm+-H,0,g) CFSE [M(H2O)6]m+( M(H2O)6]m+(aq)(dn,球形场) △hvdHmM(H2O)6m+,g
三 配位场稳定化能对过渡元素配合物稳定性的影响 众所周知,配位场理论的核心是配位体的静电场与中心离子 的作用所引起的d轨道的分裂和d电子进入低能轨道带来的稳定化 能使体系能量下降,从而产生一种附加的成键作用效应。这种附 加的成键作用效应及其大小理所当然地会在配合物的热化学性质 上表现出来。 以具有d n组态的过渡金属离子的水合焓为例。 Mm+(g)+6H2O=[M(H2O)6 ] m+(aq) △hydHm θ (Mm+ ,t N 2g eg n-N) 显然水合焓与中心离子的d轨道处于配体H2O的静电场有关。 假定这种静电场由球形对称的静电场和正八面体对称的静电场两 部分所组成,基于此,可以写出玻恩-哈伯热化学循环。 Mm+(dn ,g)+6H2O [M(H2O)6 ] m+(aq) (t2g Neg n-N) -6△bHm θ (Mm+-H2O,g) CFSE [M(H2O)6 ] m+(g) [M(H2O)6 ] m+(aq) (dn ,球形场) △hydHm θ (M(H2O)6 m+,g) ΔhydHm θ (Mm+,g)

于是,△Hm(Mm+,t2ega-)=-6△,H(M+-H,0,g十 △hdHm[M(H,O)。m+,g](d,球形场)十CFSE 其中,一6△,HMm+-H,O,g是配体与金属离子成键的能量变化, △hydH(M(H,O)6m+,g)是生成球形对称的MH,O)。m+(aq)的水 合能 CFSE是正八面体静电场使d轨道分裂,d电子重新排布时放出 的能量。 对于过渡金属离子,随原子序数的增加,有效核电荷增大, 离子半径减小,键能和球形对称静电场水合能都应该平稳地增加 (负值增大),而CFSE部分应该有反双峰型(左)的变化规律,两部 分合起来就可得到下右 70 的图形。水合焓的这种 do d5 d10 变化规律正是CFSE随d 电子数的变化规律的体 d 现。 d8
于是,△hydHm θ (Mm+,tN 2geg n-N)=-6△bHm θ (Mm+-H2O,g)+ △hydHm θ [M(H2O)6 m+,g](dn ,球形场)+CFSE 其中,-6△bHm θ (Mm+-H2O,g)是配体与金属离子成键的能量变化, △hydHm θ (M(H2O)6 m+,g)是生成球形对称的M(H2O)6 m+(aq)的水 合能, CFSE是正八面体静电场使d轨道分裂,d电子重新排布时放出 的能量。 对于过渡金属离子,随原子序数的增加,有效核电荷增大, 离子半径减小,键能和球形对称静电场水合能都应该平稳地增加 (负值增大),而CFSE部分应该有反双峰型(左)的变化规律,两部 分合起来就可得到下右 的图形。水合焓的这种 变化规律正是CFSE随d 电子数的变化规律的体 现。 d 0 d 5 d 10 d 3 d 8

四配合物生成常数的Irving一Williams)序列 实验发现,由Mn到Zn的二价金属离子与含N配位原子 的配体生成的配合物的稳定次序,亦即它们的平衡常数, 有如下次序 Mn2+Fe2+Co2+Zn2+ d5 do d7 d8 d9 d10 这个序列叫rving-一Williams序列,这个顺序大体上与弱场 CFSE的变化顺序一致,类似于反双峰曲线的后半段,只是 谷值不在d8而是d9,其原因是姜一泰勒效应所引起的
实验发现,由Mn到Zn的二价金属离子与含N配位原子 的配体生成的配合物的稳定次序,亦即它们的平衡常数, 有如下次序 Mn2+ Zn2+ d 5 d 6 d 7 d 8 d 9 d 10 这个序列叫Irving—Williams序列,这个顺序大体上与弱场 CFSE的变化顺序一致,类似于反双峰曲线的后半段,只是 谷值不在d 8而是d 9 ,其原因是姜-泰勒效应所引起的。 四 配合物生成常数的Irving-Williams序列

五配体强场对元素氧化态稳定性的影响 众所周知,离子在形成配离子时,由于配位体的场强不同, 中心离子d轨道的分裂能不同。当配位体的场强很大时,中心离 子的成对能必定小于分裂能,此时将生成低自旋配合物。电子进 入低能级轨道,使配合物的配位场稳定化能增加,配合物的稳定 性增大,结果是可能使得某些氧化态的氧化性减弱,也可能使得 某些氧化态的氧化性加强。 以CoⅢ的水、氨、和氰根配离子的氧化性为例,其氧化性有 如下的顺序: Co(H,O)3+>Co(NH)3+>Co(CN)3- 或CoⅡ的还原性Co(H,O)。2+<Co(NH)62+<Co(CN64 Co(H,O),2+在水中可长久保存,Co(NH)62+和Co(CN)64-在 水中都不稳定。 若往C0+的水溶液中加入氨水,先得到红棕色溶液,然后 很快变为紫红色。 Co(H20)62+ Co(NH,)62+ Co(CN)3- 粉红 红棕 紫红
众所周知,离子在形成配离子时,由于配位体的场强不同, 中心离子d轨道的分裂能不同。当配位体的场强很大时,中心离 子的成对能必定小于分裂能,此时将生成低自旋配合物。电子进 入低能级轨道,使配合物的配位场稳定化能增加,配合物的稳定 性增大,结果是可能使得某些氧化态的氧化性减弱,也可能使得 某些氧化态的氧化性加强。 以CoⅢ的水、氨、和氰根配离子的氧化性为例,其氧化性有 如下的顺序: Co(H2O)6 3+ > Co(NH3 ) 6 3+ > Co(CN)6 3- 或CoⅡ的还原性 Co(H2O)6 2+ < Co(NH3 ) 6 2+ < Co(CN)6 4- Co(H2O)6 2+在水中可长久保存, Co(NH3 ) 6 2+和Co(CN)6 4-在 水中都不稳定。 若往Co2+的水溶液中加入氨水,先得到红棕色溶液,然后 很快变为紫红色。 Co(H2O)6 2+ Co(NH3 ) 6 2+ Co(CN)6 3- 粉红 红棕 紫红 五 配体强场对元素氧化态稳定性的影响

4CoNH3)62++O2+2H,0=4Co(NH)63++4OH Co(CN。4-更易被氧化,除空气中的O,之外,水也能氧化它: 4Co(CN64-+O2+2H,0=4Co(CN63-+4OH 2Co(CN)64-+2H,0=2Co(CN63-+H,+20H 其实,上述配位离子的氧化性或还原性可以从下列电极电 势看出: 配体的场强减小 Co(CN)3-+e-Co(CN)4- Co"配合物0.81V CoⅢ配合物 Co(NH3)3++e-Co(NH)2+ 的还原能力 0.1V 的氧化能力 增强 增强 ,Co(H,0)63++e一Co(H,O)62+ 1.84V Co(HO)63+的氧化能力最强,Co(CN,4-的还原能力最强
4Co(NH3 ) 6 2++O2+2H2O=4Co(NH3 ) 6 3++4OH- Co(CN)6 4-更易被氧化,除空气中的O2之外,水也能氧化它: 4Co(CN)6 4-+O2+2H2O=4Co(CN)6 3-+4OH- 2Co(CN)6 4-+2H2O=2Co(CN)6 3-+H2+2OH- 其实,上述配位离子的氧化性或还原性可以从下列电极电 势看出: Co(CN)6 3-+e Co(CN)6 4- -0.81V Co(NH3 ) 6 3++e Co(NH3 ) 6 2+ 0.1V Co(H2O)6 3++e Co(H2O)6 2+ 1.84V Co(H2O)6 3+ 的氧化能力最强,Co(CN)6 4-的还原能力最强。 CoⅡ配合物 的还原能力 增强 配体的场强减小 CoⅢ配合物 的氧化能力 增强
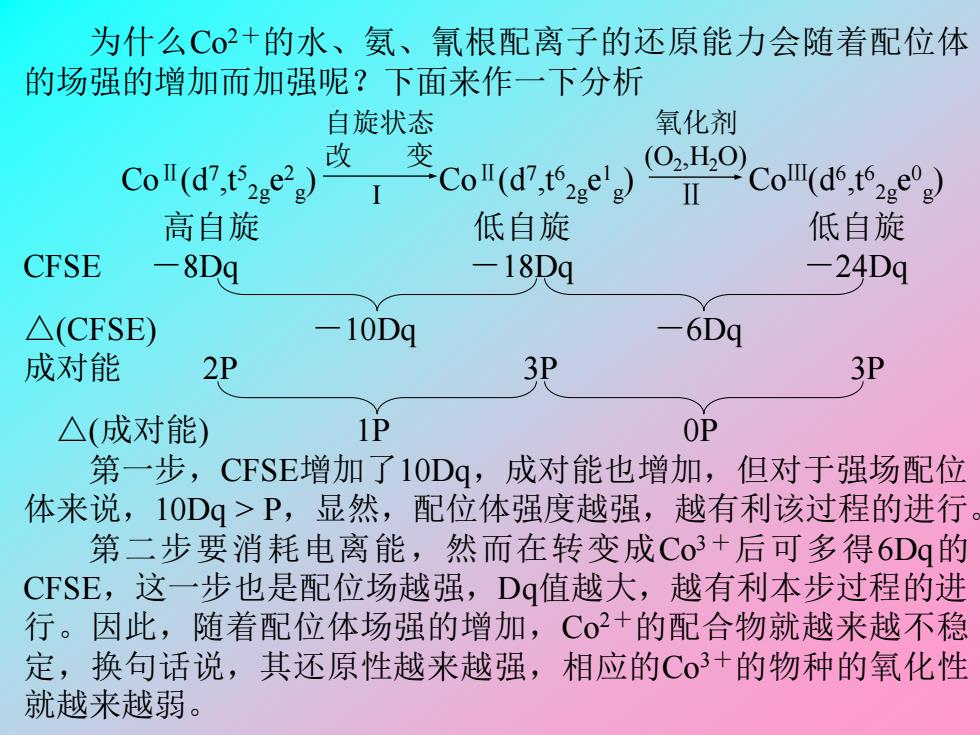
为什么Co2+的水、氨、氰根配离子的还原能力会随着配位体 的场强的增加而加强呢?下面来作一下分析 自旋状态 氧化剂 变 Coll( 改 Coll(t (0H, CoΠ(d6,t2geg 高自旋 低自旋 低自旋 CFSE 8Dq -18Dq -24Dq △(CFSE) -10Dq 6Dq 成对能 2P 3P △(成对能) 1P OP 第一步,CFSE增加了10Dq,成对能也增加,但对于强场配位 体来说,10Dq>P,显然,配位体强度越强,越有利该过程的进行 第二步要消耗电离能,然而在转变成C03+后可多得6Dg的 CFSE,这一步也是配位场越强,Dq值越大,越有利本步过程的进 行。因此,随着配位体场强的增加,Co+的配合物就越来越不稳 定,换句话说,其还原性越来越强,相应的Co3+的物种的氧化性 就越来越弱
为什么Co2+的水、氨、氰根配离子的还原能力会随着配位体 的场强的增加而加强呢?下面来作一下分析 CoⅡ(d7 ,t5 2g e 2 g ) CoⅡ(d7 ,t6 2g e 1 g ) CoⅢ(d6 ,t6 2g e 0 g ) 高自旋 低自旋 低自旋 CFSE -8Dq -18Dq -24Dq △(CFSE) -10Dq -6Dq 成对能 2P 3P 3P △(成对能) 1P 0P 第一步,CFSE增加了10Dq,成对能也增加,但对于强场配位 体来说,10Dq > P,显然,配位体强度越强,越有利该过程的进行。 第二步要消耗电离能,然而在转变成Co3+后可多得6Dq的 CFSE,这一步也是配位场越强,Dq值越大,越有利本步过程的进 行。因此,随着配位体场强的增加,Co2+的配合物就越来越不稳 定,换句话说,其还原性越来越强,相应的Co3+的物种的氧化性 就越来越弱。 自旋状态 改 变 I 氧化剂 (O2 ,H2O) Ⅱ