第十一章化学动力学 chemical kinetics BC 入检测器 硬球碰撞理论 进入真空泵 +B+ 红外化学发光实验装置示意图
第十一章 化学动力学 chemical kinetics

化学动力学发展简史 .1891年Arrhenius k=Aexp(- Svante August Arrhenius阿累尼鸟斯 瑞典化学家(1859-1927 1903年因他提出了电离理论而获Nobel 化学奖
化学动力学发展简史 a exp( ) E k A RT •1891 年 Arrhenius = − Svante August Arrhenius阿累尼乌斯 瑞典化学家(1859-1927) 1903年因他提出了电离理论而获Nobel 化学奖
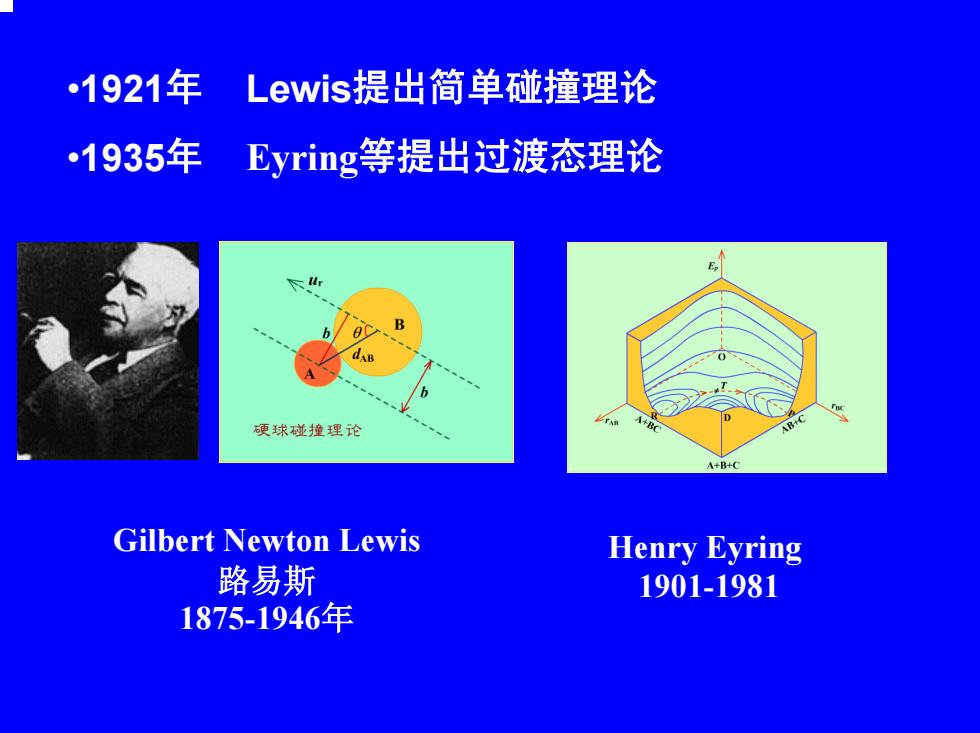
1921年 Lewis提出简单碰撞理论 1935年 Eyring等提出过渡态理论 B 硬球碰撞理论 4+B+ Gilbert Newton Lewis Henry Eyring 路易斯 1901-1981 1875-1946年
•1921年 Lewis提出简单碰撞理论 •1935年 Eyring等提出过渡态理论 Gilbert Newton Lewis 路易斯 1875-1946年 Henry Eyring 1901-1981

李远哲 (1936年11月- 1967-1968年间,李远哲自己 设计了一台交叉分子束实验装置 建立了起来。他的导师赫希巴哈 (1957年与李远哲同获诺贝尔 奖)看后称赞李远哲是“化学中的 莫扎特”。 1960年交叉分子束反应, 李远哲等人1986年获诺贝尔化学 奖
李远哲 (1936年11月- ) 1967-1968年间,李远哲自己 设计了一台交叉分子束实验装置 建立了起来。他的导师赫希巴哈 (1957年与李远哲同获诺贝尔 奖)看后称赞李远哲是“化学中的 莫扎特”。 1960年 交叉分子束反应, 李远哲等人1986年获诺贝尔化学 奖
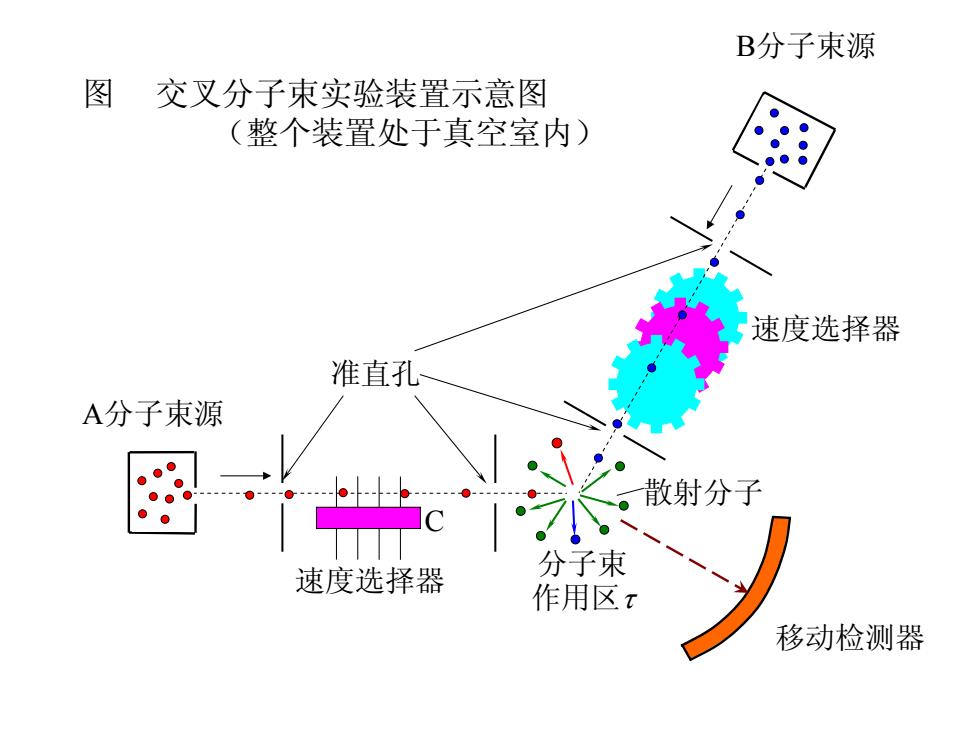
B分子束源 图 交叉分子束实验装置示意图 (整个装置处于真空室内) 速度选择器 准直孔 A分子束源 速度选择器 分子束 作用区x 移动检测器
图 交叉分子束实验装置示意图 (整个装置处于真空室内) 准直孔 A分子束源 B分子束源 速度选择器 速度选择器 C 散射分子 分子束 作用区τ 移动检测器

11.0化学动力学研究的内容与方法 11.0.1化学动力学研究的内容 ●研究浓度、温度、催化剂、溶剂、离子 强度、光照等对化学反应速率(chemical reaction rate)影响的规律; ●研究化学反应经历的具体步骤,即反应 机理(反应历程)(nechanism ofreaction)
11.0 化学动力学研究的内容与方法 11.0.1 化学动力学研究的内容 z研究浓度、温度、催化剂、溶剂、离子 强度、光照等对化学反应速率(chemical reaction rate)影响的规律; z研究化学反应经历的具体步骤,即反应 机理(反应历程)(mechanism of reaction)

11.0.2化学动力学与化学热力学的关系 化学热力学一研究物质变化 过程的能量效应及过程的方 解决 物质变化过程的可能性 向与限度,即有关平衡的规 律; 化学动力学一研究完成该过 程所需要的时间以及实现这 解决 如何把这种可能性变为 一过程的具体步骤,即有关 现实性。 速率的规律;
11.0.2 化学动力学与化学热力学的关系 化学热力学 — 研究物质变化 过程的能量效应及过程的方 向与限度,即有关平衡的规 律; 解决 物质变化过程的可能性 化学动力学 — 研究完成该过 程所需要的时间以及实现这 一过程的具体步骤,即有关 速率的规律; 解决 如何把这种可能性变为 现实性

化学热力学的研究对象和局限性 研究化学变化的方向、能达到的最大限度以及 外界条件对平衡的影响。化学热力学只能预测反应 的可能性,但无法预料反应能否发生?反应的速率 如何?反应的机理如何?例如: A,Ge/kJ.mol- 3 5N2+号H2-→NH,(g) -16.63 H2+号0,→H,00 -237.19 热力学只能判断这两个反应都能发生,但如何使它发 生,热力学无法回答
化学热力学的研究对象和局限性 研究化学变化的方向、能达到的最大限度以及 外界条件对平衡的影响。化学热力学只能预测反应 的可能性,但无法预料反应能否发生?反应的速率 如何?反应的机理如何?例如: 热力学只能判断这两个反应都能发生,但如何使它发 生,热力学无法回答。 2 2 3 2 2 2 1 3 N H N H ( g ) 2 2 1 H O H O ( l ) 2 + ⎯ ⎯→ + ⎯ ⎯→ 1 r m kJ mol − ∆ ⋅ \ G -16.63 -237.19

化学动力学的研究对象 化学动力学研究化学反应的速率和反应的机理以及 温度、压力、催化剂、溶剂和光照等外界因素对反应 速率的影响,把热力学的反应可能性变为现实性。 例如: 动力学认为: N,+3H,→NH,g) 需一定的T,p和催化剂 日2+ 502→H200 点火,加温或催化剂
化学动力学的研究对象 化学动力学研究化学反应的速率和反应的机理以及 温度、压力、催化剂、溶剂和光照等外界因素对反应 速率的影响,把热力学的反应可能性变为现实性。 2 2 3 2 2 2 1 3 N H N H ( 2 2 1 H O H O ( l ) 2 + → + → 例如: 动力学认为: g ) 需一定的 T, p和催化剂 点火,加温或催化剂

11.0.3化学动力学的研究方法 宏观反应动力学(nacroscopic reaction kenitics) 微观反应动力学(microscopic reaction kenitics), 分子反应动态学(nolecular reaction dynamics) 11.0.4反应机理与基元反应 ()反应机理 一个化学反应由反应物到生成物的反应过程中 经历的真实反应步骤,这些真实反应步骤的集合构 成反应机理。 总包反应(overall reaction) 复合反应(complex reaction)
11.0.3 化学动力学的研究方法 • 宏观反应动力学(macroscopic reaction kenitics) • 微观反应动力学(microscopic reaction kenitics) 分子反应动态学(molecular reaction dynamics) 11.0.4 反应机理与基元反应 (1)反应机理 一个化学反应由反应物到生成物的反应过程中 经历的真实反应步骤,这些真实反应步骤的集合构 成反应机理。 总包反应(overall reaction) 复合反应(complex reaction)