
二、质子转移反应类型的滴定 1.强酸(碱)的滴定 〈例)2.0×104 mol/L NaOH滴定2.0×10 mol/L HC1,是否 可行,求突跃大小。若pHp=6,求TE。 解:强碱滴定强酸生成水是生成反应型弘与沉淀生成同),滴 定可行性判据为 c64×10。 [D [H1=oH1=(kw)=10×107 (x10) =10% (107)3 恰好满足精密滴定
〈例〉 4 2.0 10− × mol/L NaOH 滴定 4 2.0 10− × mol/L HCl,是否 可行,求突跃大小。若 pHep = 6,求 TE。 解:强碱滴定强酸生成水是生成反应型(与沉淀生成同),滴 定可行性判据为 6 2 2 , 10 [ ] × eq D eq D c 。 恰好满足精密滴定 6 7 2 4 2 2 2 , 2 7 1 10 (10 ) (1 10 ) [ ] [ ] [ ] ( ) 1.0 10 = × = = = = × − − + − − eq D eq eq eq W D c H OH K 二、质子转移反应类型的滴定 1. 强酸(碱)的滴定

突跃大小:y 0.001×cD,9= 0.001×10- -=0.5 2[Dle 2×107 ApH .sinh-()-sinh(05)=021 2303 2.303 突跃0.42个pH单位:6.79-721 △pH=6-7=-1 TE D10"-10")_10’x0-10=-1% CD.eq 104 或 TE= 2[D1a sinh(2.303△pH) CD.ea 2×107 10 sinh[2.303×(-1)]=-9.9×103
突跃大小: 0.5 2 10 0.001 10 2 [ ] 0.001 7 4 , = × × = × = − − eq D eq D c y 0.21 2.303 sinh ( 0.5 ) 2.303 sinh ( ) 1 1 ∆ = = = − − y pH 突跃 0.42 个 pH 单位:6.79-7.21 1 % 10 [ ] (10 10 ) 10 (10 10 ) 6 7 1 4 7 1 1 , = − × − = − = ∆ = − = − − ∆ − − ∆ − D eq pH pH eq c D TE pH 或 sinh( 2.303 ) 2 [ ] , pH c D TE D eq eq = ∆ 3 4 7 sinh[ 2.303 ( 1)] 9.9 10 10 2 10 − − − × − = − × × =

2.强酸与弱酸混合酸的滴定 (例>0.02mol/LHCl与0.02mol/LHAc混合液用0.02molL NaOH滴定,能否滴定HCl和连续滴定HAc? 解:滴定HCl,化学计量点为HAc和HO [H]=[OH]+[Ac] [H']ea=[Acleg [H]=(KCHA) =(1.8×103×0.01)2=42×10 判别式 Caa 2 Cl.eq 0.012 [D [H (42×104月 =567×102<10 不能选择性滴定HCI,故淡不上连续滴定HAc
〈例〉0.02 mol/L HCl与 0.02 mol/L HAc混合液用0.02 mol/L NaOH 滴定,能否滴定HCl 和连续滴定HAc? 解:滴定HCl,化学计量点为HAc 和 H2O [H+] = [OH-] + [Ac-] [H+]eq = [Ac-]eq 2 4 1 5 2 1 , (1.8 10 0.01) 4.2 10 [ ] ( ) − − + = × × = × = H eq Ka HAc cHAc eq 判别式 2 4 4 2 2 2 2 , 2 2 , 5.67 10 10 (4.2 10 ) 0.01 [ ] [ ] = × < × = = + − eq HCl eq eq HCl eq H c D c 不能选择性滴定HCl,故谈不上连续滴定HAc。 2. 强酸与弱酸混合酸的滴定

那么能否滴定总量? [H门+HAc=[OH]→[HAc]g=[OH] [D]eg=[HAc]ea [T]eg=[OH]eg [HA.-=IOHr1=(K,ce网 可行性 [0.02+0.02)/3] 0.0132 [D (KCHAc.eg) 104 0.02 1810-3 3 =4.6×107>10 可滴合量 计量点 IOH1=(KG购)为 10-14 1.8×10 67x103)=1052 pH=8.28
那么能否滴定总量? [H+] + [HAc] = [OH-] ⇒ [HAc]eq = [OH-]eq [D]eq = [HAc]eq [T] eq = [OH-]eq 2 1 , [ ] [ ] ( ) HAc eq OH eq KbcHAc eq = = − 可行性: 可滴合量 7 6 5 14 2 , 2 2 2 , 4.6 10 10 3 0.02 1.8 10 10 0.013 ( ) [(0.02 0.02)/ 3] [ ] = × > × = + = − − eq b HAc eq D eq D K c c 计量点 2 1 , [ ] ( ) eq b HAc eq OH = K c − 2 5.72 1 3 5 14 6. . 7 10 ) 10 1.8 10 10 ( − − − − × = × = pH = 8.28

由此:滴定一元弱酸 c=A≥10 或cK≥10- CHAKD Ko 滴定一元弱碱 B≥10° 或cK.≥10-8 CBKa K。 强酸+弱酸选择滴定 ≥10% 强碱+弱碱选择滴定 210 注:c均为化学计量点时的分析浓度
由此:滴定一元弱酸 8 a 6 b HA HA b 2 HA 10 10 − = ≥ cK ≥ K c c K c 或 滴定一元弱碱 8 b 6 a B B a 2 B 10 10 − = ≥ cK ≥ K c c K c 或 强酸 +弱酸选择滴定 6 HA a 2 H 10 HA ≥ + c K c 强碱 +弱碱选择滴定 6 B b 2 OH 10 B ≥ − c K c 注: c均为化学计量点时的分析浓度

3,两种一元弱酸混合酸的滴定 (例〉0.02 mol/L NaOH滴定含0.02mol/LHAc和0.02 mol/L NH,CI的混合液,可否选择滴定,连续滴定?如能 滴,随机误差多大? 解:人w>K;,先滴HAc,化学计量点为Ac和NH4 [H]+[HAc]三NH]+[OH] 近似 [HAcleg [NH3]ea 相当于NH3+HAc=NH+AC滴定反应 K:=INH:I[AC 1 [H']K [NH,]HAc [H']K
〈例〉0.02 mol/L NaOH 滴定含 0.02 mol/L HAc 和 0.02 mol/L NH4Cl 的混合液,可否选择滴定,连续滴定?如能 滴,随机误差多大? 解: + > 4 NH HAc Ka Ka ,先滴HAc,化学计量点为Ac-和 NH4+ [H+] + [HAc] = [NH3] + [OH-] 近似 [HAc]eq = [NH3]eq 相当于 NH 3 + HAc = NH4+ + Ac- 滴定反应 + = = + + − + 4 [ ] [ ] [ ][ ] [ ][ ] 3 4 NH HAc a a t K K H H NH HAc NH Ac K 3. 两种一元弱酸混合酸的滴定
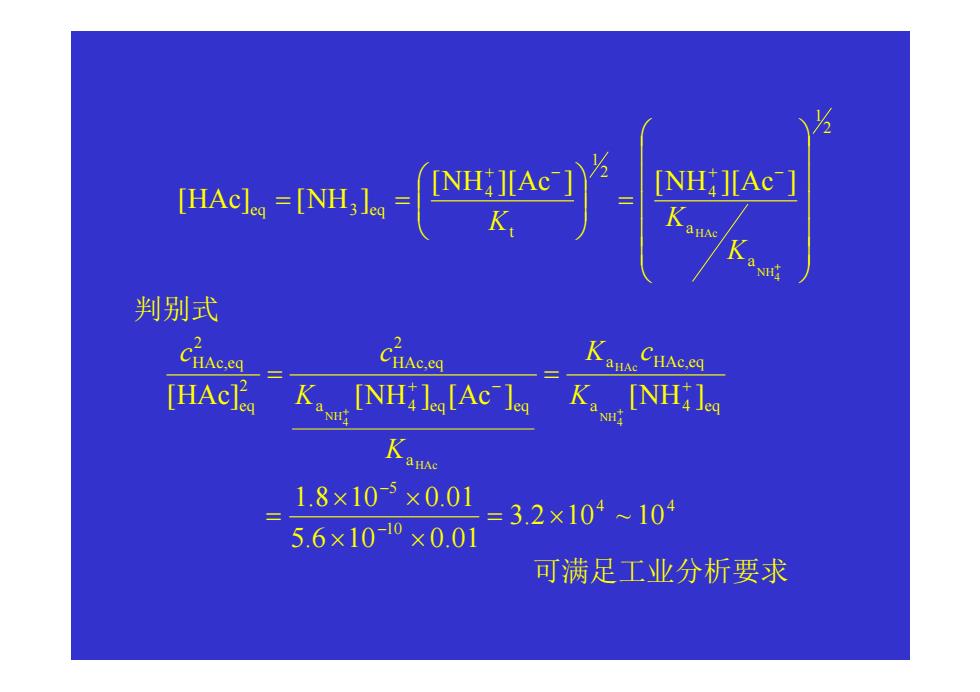
NH 判别式 Cice Cc anAe CHAc.eq [HAc K [NH:lg[Ac lea K[NHi l NH Kanse 1.8×10-×0.01 =3.2×104104 5.6×100×0.01 可满足工业分析要求
2 1 a a 4 2 1 t 4 eq 3 eq 4 NH HAc [NH ][Ac ] [NH ][Ac ] [HAc ] [NH ] = = = + + − + − K K K 判别式 a 4 eq a HAc,eq a a 4 eq eq 2 HAc,eq 2 eq 2 HAc,eq [HAc ] [NH ] [Ac ] [NH ] 4 NH HAc HAc 4 NH + − + + + = = K K c K K c c 4 4 10 5 3.2 10 ~ 10 5.6 10 0.01 1.8 10 0.01 = × × × × × = − − 可满足工业分析要求

求[H]ea: [HAclea= 5.6×1010 1.8×10 ×0.01×0.01 =5.6×10- [H1= K.[HAcl_18×103×5.6×10 =1.0×107 [Acle 0.01 pH=7.00 TE= D1(10-10p) △pH=t0.2 CHAc.q TE= 56×10-5×(102-10-02 =±0.005=±05% 0.01 或TE= 2[D sinh(2303△pH) CHAc.eq 2×5.6×10 sinh(2303×02)=±5×10 0.01
求[H + ]eq: pH 7.00 1.0 10 0.01 1.8 10 5.6 10 [Ac ] [HAc] [ H ] 0.01 0.01 5.6 10 1.8 10 5.6 10 [HAc ] 7 5 5 eq a eq eq 5 2 1 5 10 eq = = × × × × = = = × × × × × = − − − − + − − − K HAc,eq ∆pH ∆pH eq [D] (10 10 ) TE c − − = ∆pH = ± 0.2 3 5 HAc,eq eq 5 0.2 0.2 sinh( 2.303 0.2 ) 5 10 0.01 2 5.6 10 sinh( 2.303 pH ) 2[D] TE 0.005 0.5 % 0.01 5.6 10 (10 10 ) TE − − − − × = ± × × × = ± = ∆ = ± = ± × × − = ± c 或

第二eq:NH3,Ac和HO [H门+[HAc+NH4]=[OH] 简化 【NH,1=oH1,=(Kcm) =0.8105x0024=35x10 0.00672 判别式 [NH (35×104)2 =3.7×102<104不能滴 结论:(1)弱碱滴定弱酸,及强碱滴定混合一元弱酸第一步 K'C4≥10°(10) ao+CBe四 (2)弱酸滴定弱碱,及强酸滴定混合一元弱碱第一步 KcB,9≥10(104) KxCx
第二 eq:NH 3,Ac- 和 H 2 O [H +] + [HAc] + [NH 4 +] = [OH- ] 简化 2 1 4 , [ ] [ ] ( ) 3 4 eq eq b NH eq NH OH K c NH = = + + − 2 4 1 5 ) 3.5 10 3 0.02 ( 1.8 10 − − = × × = × 判别式 2 4 4 2 2 2 4 2 , 3.7 10 10 ( 3.5 10 ) 0.0067 [ ] 4 = × < × = + − + eq NH eq NH c 不能滴 结论: ( 1)弱碱滴定弱酸,及强碱滴定混合一元弱酸第一步 10 (10 ) 6 4 ≥ ⋅ ⋅ a + B eq a HA eq K c K c HB HA , , ( 2)弱酸滴定弱碱,及强酸滴定混合一元弱碱第一步 10 (10 ) 6 4 ≥ ⋅ ⋅ − b − A eq b B eq K c K c A B ,

4.多元酸碱的滴定 (1)强碱滴定多元弱酸 21000) K2 K2210(00) Kc≥10(100) (2)强酸滴定多元弱碱 ≤≥1000) K2≥10(10) K3c≥10-8(100)
4. 多元酸碱的滴定 (1)强碱滴定多元弱酸 10 (10 ) 10 (10 ) 10 (10 ) 8 10 a3 6 4 a3 6 4 a2 a2 a1 − − ≥ ≥ K c ≥ K K K K (2)强酸滴定多元弱碱 10 (10 ) 10 (10 ) 10 (10 ) 8 10 b3 6 4 b3 6 4 b2 b2 b1 − − ≥ ≥ K c ≥ K K K K