
§3-2质子转移反应类型的滴定 Bronsted酸碱理论认为酸碱反应的实质是质子的 转移。与生成反应相同之处是强酸强碱反应生成 水与沉淀形成反应相同,离子积型Kw=[H][OH ]。强酸(碱)滴定一元弱碱(酸)是 元弱酸(弱 碱)的生成反应,与络合形成反应相似 不同点:(1)水是强酸强碱滴定的产物,是溶 剂,酸碱滴定体系总是隐含着在滴定前已进行了 一步强酸强碱滴定;(2)HO是两性物质,凡两 性物质均要考虑既得质子又失质子
§3-2 质子转移反应类型的滴定 质子转移反应类型的滴定 Bronsted酸碱理论认为酸碱反应的实质是质子的 转移。与生成反应相同之处是强酸强碱反应生成 水与沉淀形成反应相同,离子积型KW = [H+][OH- ]。强酸(碱)滴定一元弱碱(酸)是一元弱酸(弱 碱)的生成反应,与络合形成反应相似。 不同点:(1)水是强酸强碱滴定的产物,是溶 剂,酸碱滴定体系总是隐含着在滴定前已进行了 一步强酸强碱滴定;(2)H2O是两性物质,凡两 性物质均要考虑既得质子又失质子

。 质子平衡条件及]的计算 1.质子平衡条件 将在溶液中大量存在并参与质子得失的物质称为参 考水准,将其得质子产物的平衡浓度乘以相应得到的 质子数写在等式的左边,将其失质子产物的平衡浓度 乘以相应失去的质子数写在等式的右边。 例 HAc:HAC,H2O [H]=[Ac]+[OH] NaAc:Ac,H2O [H]+[HAc]=[OH] H,CO::H2CO,H2O [H]=[HCO,]+2[CO,2]+[OH] NaHCO;:HCO;,H2O [H]+[H2CO;]=[CO;]+[OH]
一. 质子平衡条件及[H+]的计算 1.质子平衡条件 将在溶液中大量存在并参与质子得失的物质称为参 考水准,将其得质子产物的平衡浓度乘以相应得到的 质子数写在等式的左边,将其失质子产物的平衡浓度 乘以相应失去的质子数写在等式的右边。 例 HAc : HAc,H2O [H+] = [Ac-] + [OH-] NaAc : Ac-,H2O [H+] + [HAc] = [OH-] H2CO3 : H2CO3,H2O [H+] = [HCO3-] + 2[CO32-] + [OH-] NaHCO3 : HCO3-,H2O [H+] + [H2CO3] = [CO32-] + [OH-]

HCO3的质子条件是HCl滴定Na2CO3或NaHCO3至 HC0的化学计量点的质子条件,即c:-2caco,=0时的质 子条件: 滴定至第计量点前: CH*-2CNO2CO,=[H+]-[OH-]-[HCO3 ]-2[CO-] 或 Ci -CNaHRCO,=[H*]-[OH-]-[HCO]-2[CO1. 其中Ct=CH一Ca,o, HCI滴定Na2CO至NaHCO,计量点前cr-ca,co,≠0的质 子条件: CH -CNa2co,=[H']-[OH-]+[H2CO3 ]-[CO] 利用质子条件式可得到门与分析浓度的关系: 平衡浓度均用ca,cod代入,得到四次方程式,用计算机 可解各滴定点的H+],并可绘制出滴定曲线
H2CO3 的质子条件是 HCl 滴定 Na2CO3 或 NaHCO3 至 H2CO3 的化学计量点的质子条件,即 2 0 H Na 2CO3 c + − c = 时的质 子条件: 滴定至第二计量点前: 2 [H ] [OH ] [HCO ] 2[CO ] 2 H Na CO 3 3 2 3 + − − − c + − c = − − − 或 [H ] [OH ] [HCO ] 2[CO ], 2 NaHCO 3 3 'H 3 + − − − c + − c = − − − 其中 H Na 2CO3 'Hc + = c + − c HCl 滴定 Na2CO3至 NaHCO3计量点前 0 H Na 2CO3 c + − c ≠ 的质 子条件: [H ] [OH ] [H CO ] [CO ] 2 H Na CO 2 3 3 2 3 + − − c + − c = − + − 利用质子条件式可得到[H+]与分析浓度的关系: 平衡浓度均用 i c δ Na 2CO3 代入,得到四次方程式,用计算机 可解各滴定点的[H+],并可绘制出滴定曲线

写质子条件时注意: (1)均有H门和[OH], 而无参考水平项 (2)有强酸、碱存在时,要考虑物料平衡 HCI [H 1-CHCI=[OH] NaAc NaOH [H ][HAc]=[OH]-CNaOH H2SO4 [H']-CH,So,=[SO4]+[OH] (3)HA-A体系 HA,H2O [H]=[A]-c [OH] A,H2O [H]+[HA]-cHA [OH]
写质子条件时注意: (1) 均有[H+]和[OH-],而无参考水平项 (2) 有强酸、碱存在时,要考虑物料平衡 HCl [H +]- cHCl = [OH-] NaAc + NaOH [H +] + [HAc] = [OH-] – cNaOH H2SO4 [H+] - 2 4 H SO c =[SO42-] + [OH-] (3) HA-A-体系 HA,H2O [H+] = [A-] - − A c + [OH-] A-,H2O [H+] + [HA] - cHA = [OH-]

2.H门的近似计算 考虑允许误差不大于2.5%时允许舍弃的界限。 (1)参照参考水平,将得失质子数最少的组分保留,这样 得质子组和失质子组至多只剩下两项。 Na2CO;:H]+[HCO3]+2[H2CO3]=[OH] →[H]+[HCO]=[OH] H:PO4: [H]=[HPO4]+2[HPO4]+3PO4]+[OH] →[H]=[HPO4]+[OH] (2)在剩下的两项中,相差20倍时可舍弃小项。 c≥20K。舍H*门c>20K。舍去OH] 即酸碱不太弱时忽略水,舍去强酸或强碱项
2.[H + ]的近似计算 考虑允许误差不大于 2.5%时允许舍弃的界限。 ( 1)参照参考水平,将得失质子数最少的组分保留,这样 得质子组和失质子组至多只剩下两项。 Na 2CO 3: [H +] + [HCO 3 -] + 2[H 2CO 3] = [OH- ] ⇒ [H +] + [HCO 3 -] = [OH- ] H 3PO 4: [H +] = [H 2PO 4 -] + 2[HPO 4 2-] + 3[PO 4 3-] + [OH- ] ⇒ [H +] = [H 2PO 4 -] + [OH- ] ( 2)在剩下的两项中,相差 20 倍时可舍弃小项。 即酸碱不太弱时忽略水,舍去强酸或强碱项。 20 舍去 [ ]; 20 舍去 [ ] + − c ≥ K ai H c > K bi OH

Ca,00,>20Ka [HCO;]=[OH CH,PO >20KB [H*]=[H,PO] K (3)cK+IoN町 =[OH] K [H1=c, K.,+[H] c>400Kb,忽略K 则 [OHT=√eK c>400K.,忽略Ka 则 [H*]=cKa
(3) 1 1 400Kb Kb c > ,忽略 则 1 [ ] b OH = cK − 1 1 1 [ ] 400 a a a H cK c K K = > + 则 ,忽略 20 [H ] [H PO ] 20 [HCO ] [OH ] H PO b 2 4 Na CO a 3 3 4 3 2 3 2 + − − − > = > = c K c K = [OH-] [OH ] 1 1 b b − K +K c [H+] [H ] 1 1 a a + + = K K c

小结: 0.01 若 c=0.01 c>20K。 则K400K. 则K。< =25×10 400 即 K.<5×10 忽略同组中门项 Ka<2.5×10- [H*]=vcKa 同理 Kb<5×10 忽略同组中[OH]项 K.<2.5×10 [OH-]=VcKp
小结: 若 c = 0.01 4 a a 5 10 20 0.01 20 − c > K 则 K K 则 K < = × 即 4 a 5 10− K < × 忽略同组中[H+]项 a 5 a K < 2.5×10 [H ] = cK − + 同理 4 b 5 10− K < × 忽略同组中[OH-]项 b 5 b K < 2.5×10 [OH ] = cK − −

(例>计算O.05mol/L NaHCO3溶液中的pH值。 HC0:Ka,=5×107,K,=8×10" 解: [+[HCO]=[CO2]+[OH] c>20Ka,舍去[H门:c>20K6,舍去[OH门 [H2CO3]=[CO32] [田子 KaK32 [H予+[H]K+KaK2 [H+[H]K+KaKa2 [H*]=VKK2=6.3×109 pH=8.20 相当于NaOH滴定HCO? [T']=[OH+[CO,2]=[CO2] D']=[H+]+[H,CO ][H2CO]
〈例〉计算 0.05 mol/L NaHCO3 溶液中的 pH 值。 H2CO3: 11 a 7 a 5 10 , 8 10 1 2 − − K = × K = × 解: [H+] + [H2CO3] = [CO32-] + [OH-] 1 20Ka c > ,舍去[H+]; b1 c > 20K ,舍去[OH-] [H2CO3] = [CO32-] 1 1 2 2 1 2 1 1 2 2 2 [ ] [ ] [ ] [ ] [ ] a a a a a a a a H H K K K K K c H H K K K H c + + = + + + + + + + 相当于NaOH滴定H2CO3 [T'] = [OH-] + [CO32-] = [CO32-] [D'] = [H+] + [H2CO3] = [H2CO3] pH 8.20 [ ] 6.3 10 9 1 2 = = = × + − H Ka Ka
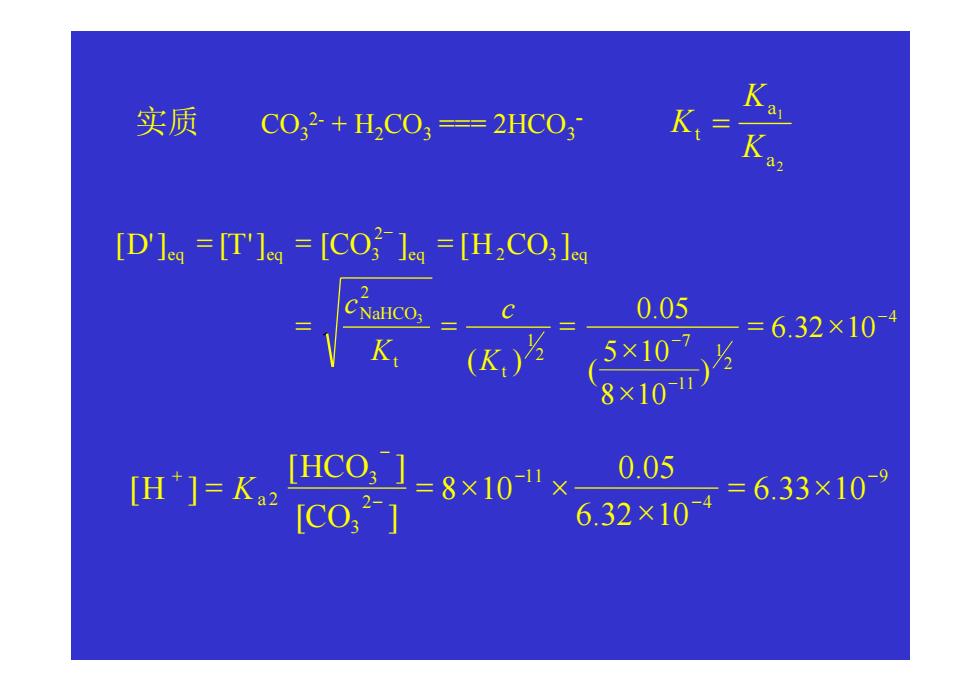
实质 CO32+HC03=2HC03 K [D'le=[T'lea=[COled =[H2CO;le 2 0.05 5×107 =632×104 K(K) 8707 m=kHC01=8x10"× 0.05 [co,*] 6,32×10=6,33×109
CO32- + H2CO3 === 2HCO3 实质 - 2 1 a a t K K K = 4 2 1 11 7 2 1 2 2 3 2 3 6.32 10 ) 8 10 5 10 ( 0.05 ( ) [ '] [ '] [ ] [ ] 3 − − − − = × × × = = = = = = t t NaHCO eq eq eq eq K c K c D T CO H CO 9 4 11 2 3 3 2 6.33 10 6.32 10 0.05 8 10 [ ] [ ] [ ] − − − − − + = × × = = × × CO HCO H Ka

〈例)求0.1 mol/L H2C2O4,NaHC2O4,Na2C2O4的[H] K=8×102,K,=1×10 (1)H2C2O4 [H]=[HC2O4]+210202]+[OH] 20K=202-201g=25x10°C,故K不能舍弃 [H的+H]K-cK=0 [H]=0.058
〈例〉求 0.1 mol/L H2C2O4, NaHC2O4, Na2C2O4 的[H+]。 4 a 2 a 8 10 , 1 10 1 2 − − K = × K = × (1)H2C2O4 [H+] = [HC2O4-] + 2[C2O42-] + [OH-] 2 2 4 1 2 H C O 12 2 4 a W b 2.5 10 8 10 1 10 20 20 20 c KK K = × 1 ,故 a1 K 不能舍弃 [H+ ]2 +[H+] 1 Ka - c 1 Ka = 0 [H+] = 0.058