
热力学研究在无机化学 中的应用 一热力学在阐明无机化学问题中的重要性 在我国,北京大学化学系已故的付鹰先生最先将热力学引进 无机化学的教学。在1956一1958年间他在讲普通化学时,自编了 讲义,其中第三章“能与化学变化”和第九章“热化学”都是讲 的化学热力学的基础知识。后来,尹敬执和申泮文教授编的基础 无机化学教材上开始有了化学热力学的初步知识介绍。 随着教材的更新,越来越感到需要运用能量变化的规律来阐 明一些化学现象,用热力学的知识来加深无机化学知识的理解。 运用热力学的知识,除能更好地阐明无机化学的四大平衡及 其联系外,还可以有助于从理论上来定量地讨论化学反应,寻求 影响反应进行的因素和指导进行无机合成。 有时,为了阐明无机物性质及其无机反应的规律,当应用了 热力学的观点时往往比单靠微观结构观点更能得到满意的结果
热力学研究在无机化学 中的应用 一 热力学在阐明无机化学问题中的重要性 在我国,北京大学化学系已故的付鹰先生最先将热力学引进 无机化学的教学。在1956-1958年间他在讲普通化学时,自编了 讲义,其中第三章“能与化学变化”和第九章“热化学”都是讲 的化学热力学的基础知识。后来,尹敬执和申泮文教授编的基础 无机化学教材上开始有了化学热力学的初步知识介绍。 随着教材的更新,越来越感到需要运用能量变化的规律来阐 明一些化学现象,用热力学的知识来加深无机化学知识的理解。 运用热力学的知识,除能更好地阐明无机化学的四大平衡及 其联系外,还可以有助于从理论上来定量地讨论化学反应,寻求 影响反应进行的因素和指导进行无机合成。 有时,为了阐明无机物性质及其无机反应的规律,当应用了 热力学的观点时往往比单靠微观结构观点更能得到满意的结果

例,磷和硅是同一族的两个元素,但是它们的氧化物的性质 相差很大: SiO,原子晶体,mp.1723℃, b.p.2230℃,不溶于水, 溶于HF酸生成SF4; C02分子晶体,mp.-78.4℃,b.p.-56.2℃,溶于水, 不溶于HF。 倘若你仅从原子结构的观点一C、Si的电子结构都是ns2np2 是很难解释它们性质上的差别的,但是从热力学角度出发,通过 比较键能的大小并结合结构理论很好地解释了这个问题。 Si-0 Si=0 C-0 C=0 键能/kJ.mol-1 464 640 360 803 若Si与O生成两条双键,键能1280 kJ.mol-1; 但四条单键1756 kJmol-1。 反过来,C与0生成两条双键,键能1606 kJ.mol-1: 但四条单键1460 kJ.mol-1
例,磷和硅是同一族的两个元素,但是它们的氧化物的性质 相差很大: SiO2 原子晶体, m.p. 1723 ℃, b.p. 2230 ℃,不溶于水, 溶于HF酸生成SiF4; CO2 分子晶体, m.p. -78.4 ℃, b.p. -56.2 ℃,溶于水, 不溶于HF。 倘若你仅从原子结构的观点-C、Si的电子结构都是ns2np2- 是很难解释它们性质上的差别的,但是从热力学角度出发,通过 比较键能的大小并结合结构理论很好地解释了这个问题。 Si-O Si=O C-O C=O 键能/kJ·mol-1 464 640 360 803 若Si与O生成两条双键,键能1280 kJ·mol-1; 但四条单键1756 kJ·mol-1 。 反过来,C与O生成两条双键,键能1606 kJ·mol-1; 但四条单键1460 kJ·mol-1

可见,从能量的观点可以得出结论:硅与氧 所形成的化合物是以Si一O单键为基础的,而C 的化合物则主要是C=O双键,所以CO,和SiO,的 结构不相同。前者是网状大分子,含有SO4四面 体结构单元,其中Si以单键与4个氧连结,氧以 两个S之间的氧桥形式存在,要破坏这种结构需 要很高的能量,所以它的溶、沸点都很高,也不 溶于水,与HF作用是生成了易挥发的SF4。后者 是线性孤立分子,分子间以分子间力联系,所以 它的溶、沸点较低
可见,从能量的观点可以得出结论:硅与氧 所形成的化合物是以Si-O单键为基础的,而C 的化合物则主要是C=O双键,所以CO2和SiO2的 结构不相同。前者是网状大分子,含有SiO4四面 体结构单元,其中Si以单键与4个氧连结,氧以 两个Si之间的氧桥形式存在,要破坏这种结构需 要很高的能量,所以它的溶、沸点都很高,也不 溶于水,与HF作用是生成了易挥发的SiF4。后者 是线性孤立分子,分子间以分子间力联系,所以 它的溶、沸点较低
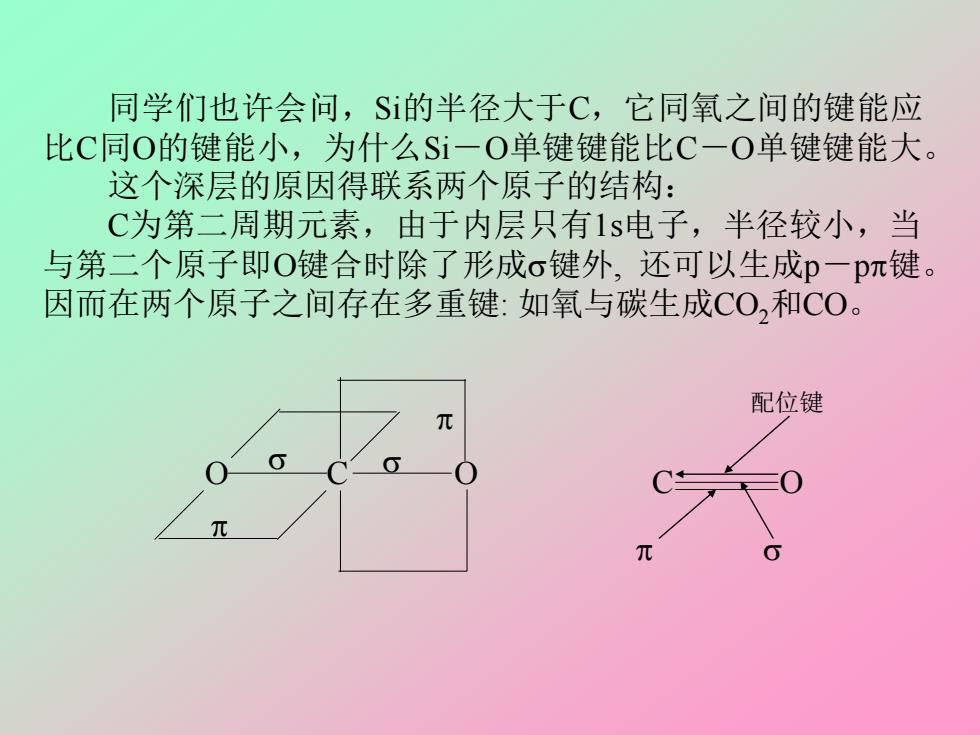
同学们也许会问,S的半径大于C,它同氧之间的键能应 比C同O的键能小,为什么Si一O单键键能比C一O单键键能大。 这个深层的原因得联系两个原子的结构: C为第二周期元素,由于内层只有1s电子,半径较小,当 与第二个原子即O键合时除了形成σ键外,还可以生成p一pπ键。 因而在两个原子之间存在多重键:如氧与碳生成CO,和C0。 配位键
同学们也许会问,Si的半径大于C,它同氧之间的键能应 比C同O的键能小,为什么Si-O单键键能比C-O单键键能大。 这个深层的原因得联系两个原子的结构: C为第二周期元素,由于内层只有1s电子,半径较小,当 与第二个原子即O键合时除了形成键外, 还可以生成p-p键。 因而在两个原子之间存在多重键: 如氧与碳生成CO2和CO。 O C O C O 配位键

而$i是第三周期元素,内层电子较多,半径较大,生成p一 pπ键难度较大,而倾向于以一定杂化态形成尽可能多的单键,因 而常以单键同其它原子结合。 但是这种单键又不同于象C一O中的那种简单的单键,因为 Si有3d空轨道,3d空轨道的能级与3p相差不远,氧上2s22p4的孤 对电子可以反馈到Si的3d轨道上生成反馈的p一dπ键,这样一来 Si与氧之间就形成了一定程度的多重键,p一dπ键的键能比p一p π键的键能要小一些,所以就有了这样的能量次序: C=0 Si=0 Si-0 C-0 o十p一pπ o十p一p元 o+p-dπ 0 803 kJ.mol-l 640 464 360 这样,Si一O单键(实际上是o十p一dπ)的键能比C-O单键 (纯σ)大就不难理解了
而Si是第三周期元素,内层电子较多,半径较大,生成p- p键难度较大,而倾向于以一定杂化态形成尽可能多的单键,因 而常以单键同其它原子结合。 但是这种单键又不同于象C-O中的那种简单的单键,因为 Si有3d空轨道,3d空轨道的能级与3p相差不远,氧上2s 22p 4的孤 对电子可以反馈到Si的3d轨道上生成反馈的p-d键,这样一来 Si与氧之间就形成了一定程度的多重键,p-d键的键能比p-p 键的键能要小一些,所以就有了这样的能量次序: C=O Si=O Si-O C-O +p-p +p-p +p-d 803 kJ·mol-1 640 464 360 这样,Si-O单键(实际上是+p-d)的键能比C-O单键 (纯)大就不难理解了
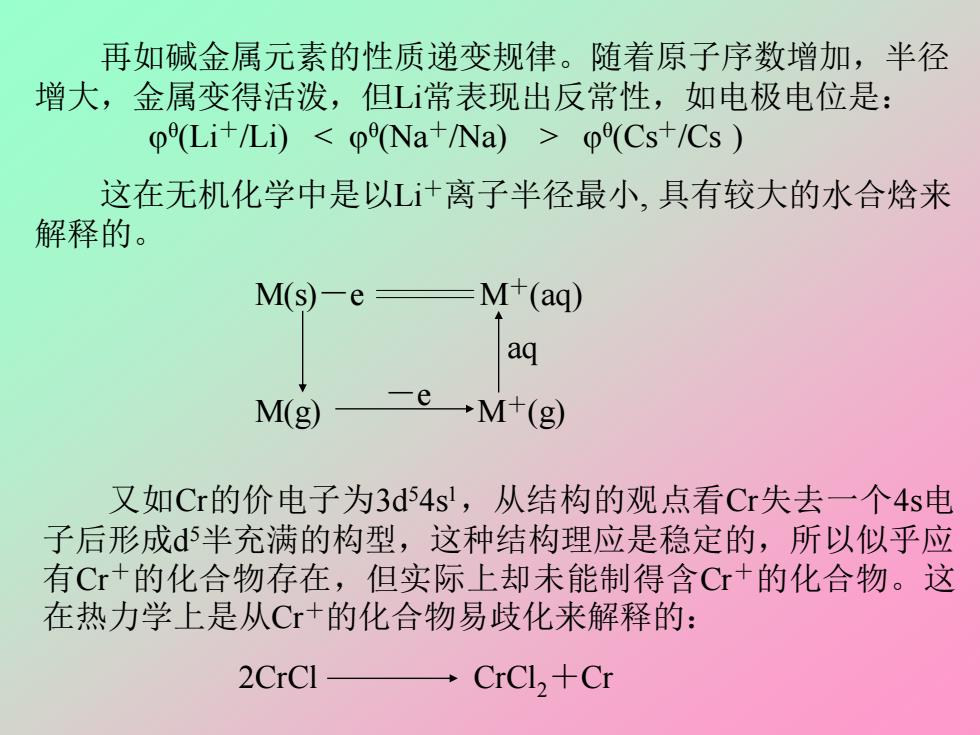
再如碱金属元素的性质递变规律。随着原子序数增加,半径 增大,金属变得活泼,但L常表现出反常性,如电极电位是: 0(Li+/Li)(Cs+/Cs 这在无机化学中是以L+离子半径最小,具有较大的水合焓来 解释的。 M(s)-e M+(aq) aq M(g) →M+(g) 又如Cr的价电子为3d54s',从结构的观点看Cr失去一个4s电 子后形成d5半充满的构型,这种结构理应是稳定的,所以似乎应 有Cr+的化合物存在,但实际上却未能制得含Cr+的化合物。这 在热力学上是从C+的化合物易歧化来解释的: 2CrCl CrCl,+Cr
再如碱金属元素的性质递变规律。随着原子序数增加,半径 增大,金属变得活泼,但Li常表现出反常性,如电极电位是: θ (Li+/Li) θ (Cs+/Cs ) 这在无机化学中是以Li+离子半径最小, 具有较大的水合焓来 解释的。 M(s)-e M+(aq) M(g) M+(g) -e aq 又如Cr的价电子为3d 54s 1 ,从结构的观点看Cr失去一个4s电 子后形成d 5半充满的构型,这种结构理应是稳定的,所以似乎应 有Cr+的化合物存在,但实际上却未能制得含Cr+的化合物。这 在热力学上是从Cr+的化合物易歧化来解释的: 2CrCl CrCl2+Cr

同学们已经很熟悉的一个反应的例子,是第一个稀有气体化合物的制备。 这是一个应用微观结构并兼顾热力学能量的一个十分典型而又引人入胜的例子。 1962年,加拿大化学家巴列特发现,只要将O,与PF在室温 下混合,PF6这个极强氧化剂就能从O2分子中夺走电子,得到 O,PtF6 O2+PtF6=O2+[PtF6J厂 巴列特将O,与稀有气体Xe进行比较,认为有可能制得XePtF6。 直径 L/kJ.mol-1晶格能/kJ.mol-l Xe 400pm Xe+≈180 1170 也应近 XePtF? 02 400 0,+ 180 1175.7 似相等 O,Ptf。V 通过热力学计算表明XePtF的生成焓为一66.56 kJ.mol-l,说 明XePtF,应能稳定存在。 于是他将PF。蒸气与X在室温混合,果然立即制得了一种不 溶于CCl4的红色晶体。当时认为是XPtF。,后来的研究表明,这 个反应并不象刚开始想的那么简单,产物也不是简单的XPtF6 但是制出这一个稀有气体化合物的事实告诉我们,在进行结构考虑的同 时,兼顾热力学方法对反应能量进行估算,这是十分有用的方法
同学们已经很熟悉的一个反应的例子,是第一个稀有气体化合物的制备。 这是一个应用微观结构并兼顾热力学能量的一个十分典型而又引人入胜的例子。 1962年,加拿大化学家巴列特发现,只要将O2与PtF6在室温 下混合,PtF6这个极强氧化剂就能从O2分子中夺走电子,得到 O2 PtF6。 O2+PtF6 =O2 +[PtF6 ]- 巴列特将O2与稀有气体Xe进行比较,认为有可能制得XePtF6。 直径 I 1 / kJ·mol-1 晶格能/ kJ·mol-1 Xe 400pm Xe+ ≈180 1170 XePtF6 ? O2 400 O2 + 180 1175.7 O2 PtF6 √ 通过热力学计算表明XePtF6的生成焓为-66.56 kJ·mol-1 ,说 明XePtF6应能稳定存在。 于是他将PtF6蒸气与Xe在室温混合,果然立即制得了一种不 溶于CCl4的红色晶体。当时认为是XePtF6,后来的研究表明,这 个反应并不象刚开始想的那么简单,产物也不是简单的XePtF6。 但是制出这一个稀有气体化合物的事实告诉我们,在进行结构考虑的同 时,兼顾热力学方法对反应能量进行估算,这是十分有用的方法。 也应近 似相等

二用热力学观点阐明无机化学问题的一般方法 例:说明气态NF,在298.15K时分解为元素是热力学稳定的, 而液态NC1,在轻微刺激下也会自发爆炸分解为N2和C2· 第一步是用热力学对这个问题进行叙述: △HmNF3)=-124.7kmol-11二者相差多达355kmol-1, △HNCI3)=230 kJ.mol-1∫ 前者稳定,后者不稳定 显然,光此是不够的,为什么NF,的生成焓低,NCL,的生成 焓高,还要作进一步探讨
二 用热力学观点阐明无机化学问题的一般方法 例:说明气态NF3在298.15K时分解为元素是热力学稳定的, 而液态NCl3在轻微刺激下也会自发爆炸分解为N2和Cl2。 第一步是用热力学对这个问题进行叙述: ΔfHm θ (NF3 )=-124.7 kJ·mol-1 ΔfHm θ (NCl3 )=230 kJ·mol-1 显然,光此是不够的,为什么NF3的生成焓低,NCl3的生成 焓高,还要作进一步探讨。 二者相差多达355 kJ·mol-1 , 前者稳定,后者不稳定

第二步是用热力学方法进行复述,设计一个可能的循环: N.()(H(NX,) NX,(g) 2AH (N2,g) AH,"(X,.s) -3△,HmN-X) N(g)+3X(g) AH(NXHN+H.)-3A.H(N-X) AHn(NCL,)-△HmNF)=A,HnCL2)-A,Hn9E2】- 3[△,HmN-CI)-,△,HmN-F)] =2[242-159]-3[192-278] =383 kJ.mol-1 返里使用了键焓的定义。 使用键能值、估算的结果二者之差为383 kJmol-1。 NCL的标准生成焓比NF,大了383 kJ-mol-l,当然NCL3比 NF,不稳定
这里使用了键焓的定义。 使用键能值、估算的结果二者之差为383 kJ·mol-1 。 NCl3的标准生成焓比NF3大了383 kJ·mol-1,当然NCl3比 NF3不稳定。 1 3 2 2 ΔbHm θ (X2 , g) 3 2 第二步是用热力学方法进行复述,设计一个可能的循环: N2 (g) + X2 (g) NX3 (g) N(g) + 3 X(g) ΔfHm θ (NX3 ,g)= ΔbHm θ (N2 ,g) + ΔbHm θ (X2 ,g) -3ΔbHm θ (N-X) ΔfHm θ (NCl3 )- ΔfHm θ (NF3 )= [ΔbHm θ (Cl2 )- ΔbHm θ (F2 )]- 3[ΔbHm θ (N-Cl) - ΔbHm θ (N-F)] = [242-159]-3[192-278] = 383 kJ·mol-1 3 2 1 3 2 2 -3ΔbHm θ (N-X) ΔfHm θ (NX3 ) ΔbHm θ (N2 , g) 1 2 3 2

第三步,根据这个分析得到热力学结论:NF?有 高的稳定性,原因是F,的低的键焓和氮形成强的共 价键。 或者:NC13比NT,的稳定性低,原因是C1,的键焓 比F,的键焓高,及氯与氮形成的共价键没有F与N形 成的共价键强之故。 由此三步,显然对该问题有了深刻的认识
第三步,根据这个分析得到热力学结论:NF3有 高的稳定性,原因是F2的低的键焓和氮形成强的共 价键。 或者:NCl3比NF3的稳定性低,原因是Cl2的键焓 比F2的键焓高,及氯与氮形成的共价键没有F与N形 成的共价键强之故。 由此三步,显然对该问题有了深刻的认识