
无机高分子 无机高分子物质的特点 构成无机高分子物质的元素 无机高分子物质的分类 无机高分子物质的命名 &∠ 无机高分子物质举例 均链无机高分子物质 丝 杂链无机高分子物质 无机环状化合物 无机笼状化合物
无机高分子 无机高分子物质的特点 构成无机高分子物质的元素 无机高分子物质的分类 无机高分子物质的命名 无机高分子物质举例 均链无机高分子物质 杂链无机高分子物质 无机环状化合物 无机笼状化合物

无机高分子 一无机高分子物质的特点 无机高分子物质也称为无机大分子物质,它与一般低分子 无机物质相比具有如下特点: ()由多个“结构单元”组成 (2)相对分子质量大 (3)相对分子质量有“多分散性” (4)分子链的几何形状复杂 二构成无机高分子物质的元素 无机高分子物质的分子则可由其他多种元素的原子构成主 链。完全由同一种元素构成的主链叫做“均链”,由不同种元 素的原子构成的主链叫做杂链。原子间主要靠共价键(包括配 位键)互相结合
无机高分子 一 无机高分子物质的特点 无机高分子物质也称为无机大分子物质,它与一般低分子 无机物质相比具有如下特点: (1) 由多个“结构单元”组成 (2) 相对分子质量大 (3) 相对分子质量有“多分散性” (4) 分子链的几何形状复杂 无机高分子物质的分子则可由其他多种元素的原子构成主 链。完全由同一种元素构成的主链叫做“均链” ,由不同种元 素的原子构成的主链叫做杂链。原子间主要靠共价键(包括配 位键)互相结合。 二 构成无机高分子物质的元素

原子间主要靠共价键(包括配位键)互相结合。 键能越大,形成的键就越稳定,靠这种键就有可能形成长 链的分子。 元素的电负性之和是判断元素之间能否生成高分子物质的 重要依据之一。 般来说,两元素电负性之和在5~6之间可以发生聚合, 电负性之和小于5,不能发生聚合。 右表列出了能生成 生成无机高分子物质的元素 无机高分子物质的元素 H 在周期表中的位置。表 B C N F 中所有的元素都能生成杂 Al Si P S CI 链无机高分子物质,有下 Ge As Se 划线的元素能生成均链无 Sn Sb Te 机高分子物质
原子间主要靠共价键(包括配位键)互相结合。 键能越大,形成的键就越稳定,靠这种键就有可能形成长 链的分子。 元素的电负性之和是判断元素之间能否生成高分子物质的 重要依据之一。 一般来说,两元素电负性之和在5~6之间可以发生聚合, 电负性之和小于5,不能发生聚合。 生成无机高分子物质的元素 H B C N O F Al Si P S Cl Ge As Se Sn Sb Te 右表列出了能生成 无机高分子物质的元素 在周期表中的位置。表 中所有的元素都能生成杂 链无机高分子物质,有下 划线的元素能生成均链无 机高分子物质

三 无机高分子物质的分类 (1)按照主链结构分类 均链高分子物质:由同一种元素的原子构成其主链。如, 链状硫 .-S-S-S- HHH 聚硅烷 HHH 杂链高分子物质:主链由不同种元素的原子构成。如, 聚磷腈化合物 .一P=N一P=N一. (2)按照高分子物质的空间因次分类 一维高分子物质:结构单元按线型连接,所以也称为链状 无机高分子物质。 二维高分子物质:结构单元是在平面上连接,形成平面型 大分子。平面分子相互按一定规律重叠构成晶体,所以也称为 层状高分子物质。 三维高分子物质:结构单元是在三维空间方向上连接,所 以也称为骨架型(或网络型)高分子物质
三 无机高分子物质的分类 (1) 按照主链结构分类 均链高分子物质:由同一种元素的原子构成其主链。如, 链状硫 .-S-S-S-. H H H 聚硅烷 .-Si-Si-Si-. H H H 杂链高分子物质:主链由不同种元素的原子构成。如, 聚磷腈化合物 .-P=N-P=N-. (2) 按照高分子物质的空间因次分类 一维高分子物质:结构单元按线型连接,所以也称为链状 无机高分子物质。 二维高分子物质:结构单元是在平面上连接,形成平面型 大分子。平面分子相互按一定规律重叠构成晶体,所以也称为 层状高分子物质。 三维高分子物质:结构单元是在三维空间方向上连接,所 以也称为骨架型(或网络型)高分子物质
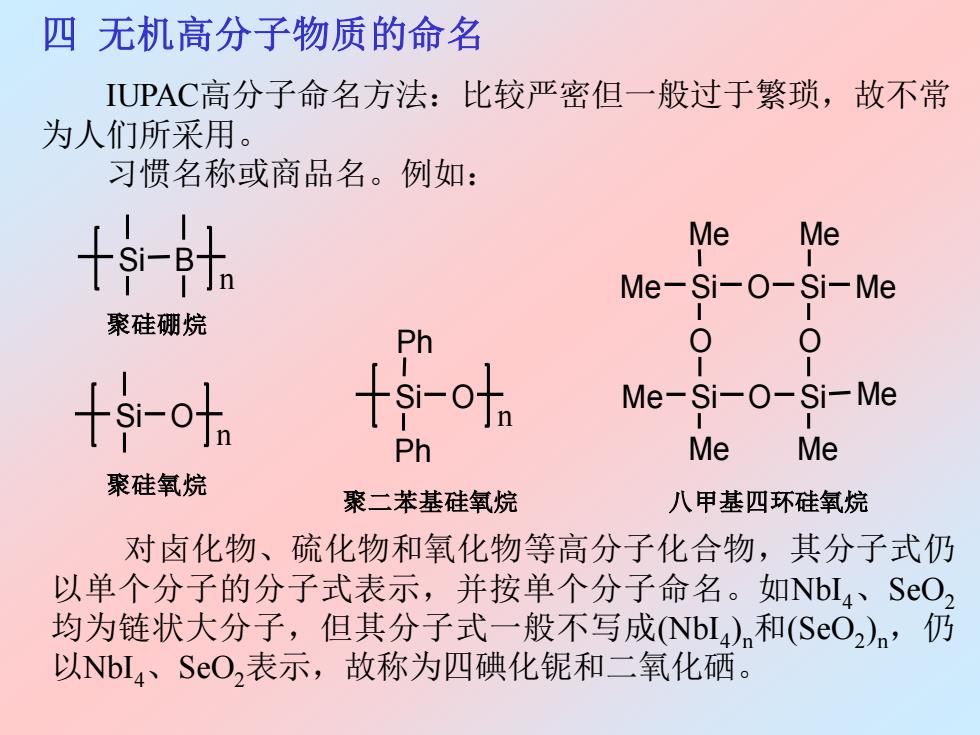
四无机高分子物质的命名 IUPAC高分子命名方法:比较严密但一般过于繁琐,故不常 为人们所采用。 习惯名称或商品名。例如: 十持t Me Me Me-Si-O-Si-Me 聚硅硼烷 Ph 0 十sr-oh 十sr-oha Me-Si-0-Si-Me Ph Me Me 聚硅氧烷 聚二苯基硅氧烷 八甲基四环硅氧烷 对卤化物、硫化物和氧化物等高分子化合物,其分子式仍 以单个分子的分子式表示,并按单个分子命名。如Nbl4、SO2 均为链状大分子,但其分子式一般不写成(NbI4)n和(SO2)n,仍 以NbL4、SO,表示,故称为四碘化铌和二氧化硒
四 无机高分子物质的命名 IUPAC高分子命名方法:比较严密但一般过于繁琐,故不常 为人们所采用。 习惯名称或商品名。例如: Si B n Si O n Si O Ph Ph n Me Si O Me O Si Me Me O Me Si O Me Si Me Me 聚硅硼烷 聚硅氧烷 聚二苯基硅氧烷 八甲基四环硅氧烷 对卤化物、硫化物和氧化物等高分子化合物,其分子式仍 以单个分子的分子式表示,并按单个分子命名。如NbI4、SeO2 均为链状大分子,但其分子式一般不写成(NbI4 ) n和(SeO2 ) n,仍 以NbI4、SeO2表示,故称为四碘化铌和二氧化硒

五无机高分子物质举例 1均链无机高分子物质 ()链状硫 链状硫的分子是由许多个$原子靠共价键连成的长链 .-S-S-S-. “一S一”就是其中的结构单元。 链状硫在氮气或其他惰性气体中,将硫于300℃下加热 5mi,然后倾入冰水中,即生成纤维状的弹性硫,它是由 螺旋状长链硫(S)所组成。链状硫不溶于CS,在室温下放置 则硬化而失去弹性,慢慢解聚变成S?,光照可促进解聚。若 在硫的熔融体中加入磷、卤素或碱金属,可提高链状硫的稳 定性。这是因为他们与硫链末端的硫反应形成了端基,从而 能够稳定硫链的末端之故。例如,多硫化钾K[S]K、多硫化 碘[S]I等都比较稳定
五 无机高分子物质举例 1 均链无机高分子物质 (1) 链状硫 链状硫的分子是由许多个S原子靠共价键连成的长链 .-S-S-S-. “-S-”就是其中的结构单元。 链状硫在氮气或其他惰性气体中,将硫于300 ℃下加热 5 min,然后倾入冰水中,即生成纤维状的弹性硫,它是由 螺旋状长链硫(S)n所组成。链状硫不溶于CS2,在室温下放置 则硬化而失去弹性,慢慢解聚变成S8,光照可促进解聚。若 在硫的熔融体中加入磷、卤素或碱金属,可提高链状硫的稳 定性。这是因为他们与硫链末端的硫反应形成了端基,从而 能够稳定硫链的末端之故。例如,多硫化钾K[S]nK、多硫化 碘I[S]n I等都比较稳定

(2)聚硅烷和聚卤代硅烷 将硅化钙与含有冰醋酸或盐酸的醇溶液作用,测生成高相 对分子质量的链状聚硅烷[SH],其结构类似于聚乙烯; 用惰性气体稀释的四氯化硅或四溴化硅通入1000~1100℃ 的反应器内,反应生成了和[SiH]n类似的聚卤代硅烷[SiX2]n 将CH3)2SC1,与熔融的金属钠反应,可生成聚二甲基硅烷: n(CH3)2SiC+2nNa-[(CH3)2Si]-+2nNaCl 在空气中把聚二甲基硅烷于200℃加热16h即得固化的聚二 甲基硅烷。聚二甲基硅烷对水十分稳定,在其他化学试剂中也 有良好的稳定性,如在NaOH水溶液中可长时间浸渍,性质和 形状均不发生变化
(2) 聚硅烷和聚卤代硅烷 将硅化钙与含有冰醋酸或盐酸的醇溶液作用,则生成高相 对分子质量的链状聚硅烷[SiH2 ] n,其结构类似于聚乙烯; 用惰性气体稀释的四氯化硅或四溴化硅通入1000~1100 ℃ 的反应器内,反应生成了和[SiH2 ] n类似的聚卤代硅烷[SiX2 ] n。 将(CH3 ) 2 SiCl2与熔融的金属钠反应, 可生成聚二甲基硅烷: n(CH3 ) 2 SiCl2 + 2nNa —→ -[(CH3 ) 2 Si]n- + 2nNaCl 在空气中把聚二甲基硅烷于200℃加热16 h即得固化的聚二 甲基硅烷。聚二甲基硅烷对水十分稳定,在其他化学试剂中也 有良好的稳定性,如在NaOH水溶液中可长时间浸渍,性质和 形状均不发生变化
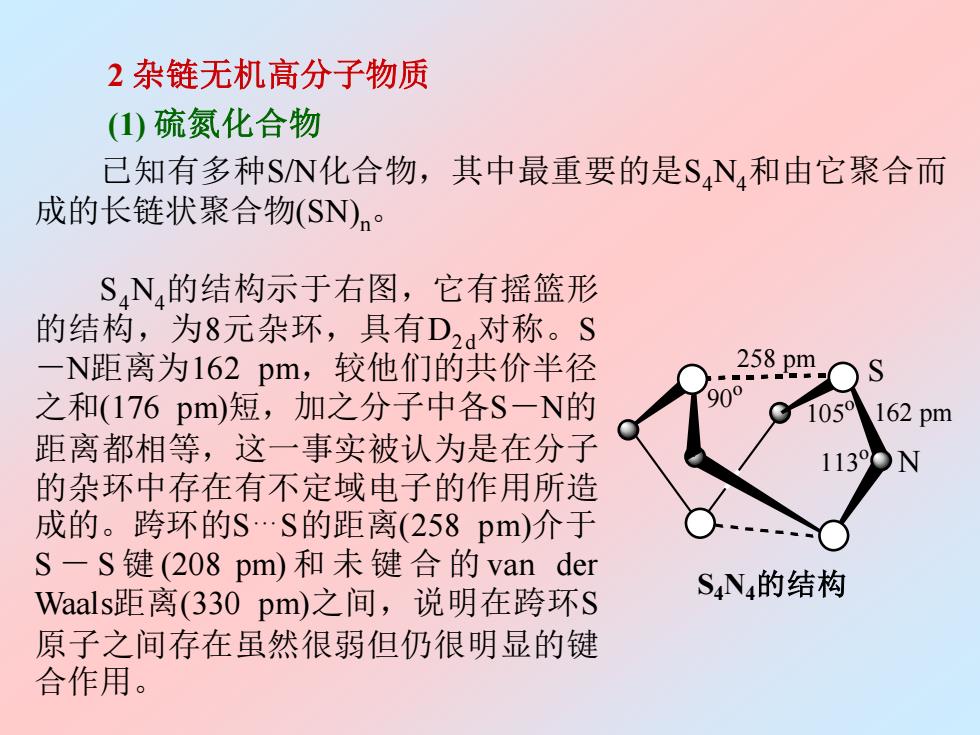
2杂链无机高分子物质 (①)硫氮化合物 己知有多种SN化合物,其中最重要的是SN,和由它聚合而 成的长链状聚合物(SN)n· S,N的结构示于右图,它有摇篮形 的结构,为8元杂环,具有D2对称。S 一N距离为162pm,较他们的共价半径 258pm S 之和(176pm)短,加之分子中各S-N的 1059 162pm 距离都相等,这一事实被认为是在分子 的杂环中存在有不定域电子的作用所造 成的。跨环的S.S的距离(258pm)介于 S一S键(208pm)和未键合的van der Waals距离(330pm)之间,说明在跨环S S4N4的结构 原子之间存在虽然很弱但仍很明显的键 合作用
2 杂链无机高分子物质 (1) 硫氮化合物 已知有多种S/N化合物,其中最重要的是S4N4和由它聚合而 成的长链状聚合物(SN)n。 90 o 105 o 113 o 162 pm 258 pm S N S4N4的结构 S4N4的结构示于右图,它有摇篮形 的结构,为8元杂环,具有D2d对称。S -N距离为162 pm,较他们的共价半径 之和(176 pm)短,加之分子中各S-N的 距离都相等,这一事实被认为是在分子 的杂环中存在有不定域电子的作用所造 成的。跨环的S.S的距离(258 pm)介于 S - S 键 (208 pm) 和未键合的 van der Waals距离(330 pm)之间,说明在跨环S 原子之间存在虽然很弱但仍很明显的键 合作用

把S4N4蒸气加热到300℃,生成S,N2。S,N2非常不稳定, 在室温即聚合成(SN)n· (SN)是迄今唯一已知具有超导性质的链状无机高分子。 (SN)为长链状结构,各链彼此平行地排列在晶体中,相邻 分子链之间以van der Waals力相结合。(SN)n晶体在电性质 等方面具有各向异性性。在室温下,沿键方向的导电率与 Hg等金属相近,约为数十万Sm-1,而垂直于键方向的导电 率仅为1000Sm-1。在5K时可达5×107Sm-1,在0.26K 以下为超导体。 超导体(S),的获得,首次证明不含金属原子的系统也 可能具有超导性。(SN)也是在合成和研究具有超导性的一 维各向异性化合物中,所取得的第一个成果。 As4S4的结构(右图)与 S4N4的结构类似,但其 中V族元素和I族元素 互相交换了位置
把S4N4蒸气加热到300 ℃,生成S2N2。S2N2非常不稳定, 在室温即聚合成(SN)n。 (SN)n是迄今唯一已知具有超导性质的链状无机高分子。 (SN)n为长链状结构,各链彼此平行地排列在晶体中,相邻 分子链之间以van der Waals力相结合。(SN)n晶体在电性质 等方面具有各向异性性。在室温下,沿键方向的导电率与 Hg等金属相近,约为数十万S·m-1 ,而垂直于键方向的导电 率仅为1 000 S·m-1 。在5 K时可达5×107 S·m-1 ,在0.26 K 以下为超导体。 超导体(SN)n的获得, 首次证明不含金属原子的系统也 可能具有超导性。(SN)n也是在合成和研究具有超导性的一 维各向异性化合物中,所取得的第一个成果。 As4 S4的结构(右图)与 S4N4的结构类似,但其 中Ⅴ族元素和Ⅵ族元素 互相交换了位置。 S N
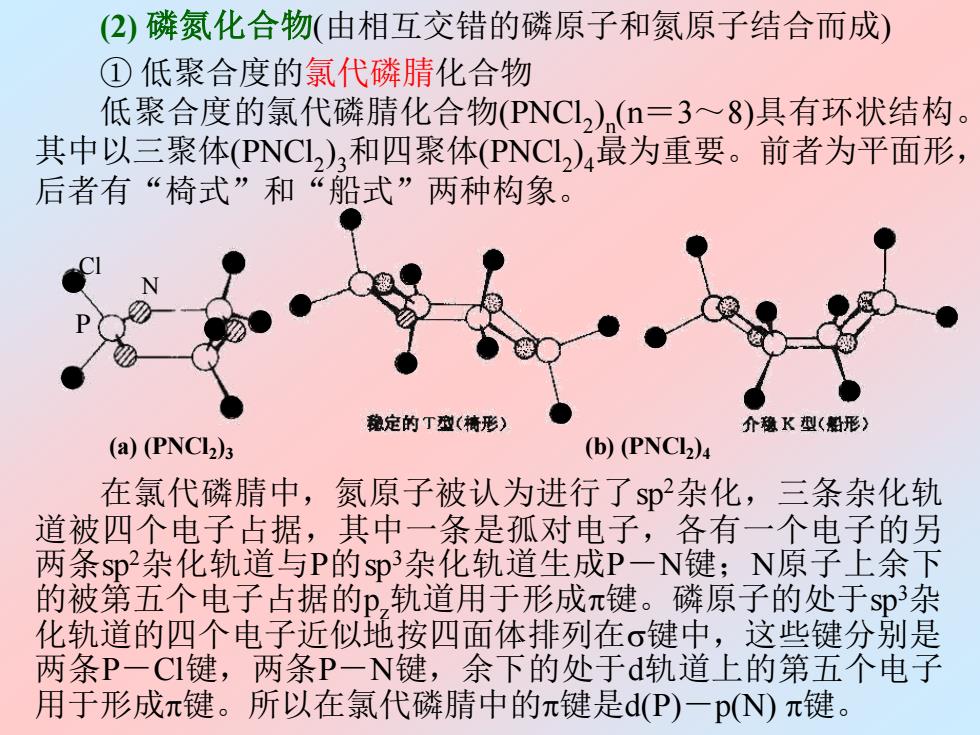
(2)磷氮化合物(由相互交错的磷原子和氮原子结合而成) ①低聚合度的氯代磷腈化合物 低聚合度的氯代磷睛化合物(PNC12)(n=3~8)具有环状结构。 其中以三聚体(PNCL2)3和四聚体(PNCL)4最为重要。前者为平面形, 后者有“椅式”和“船式”两种构象。 魏定的丁型(墙形) 介稳K型(船形) (a)(PNCI)3 (b)(PNCI) 在氯代磷腈中,氮原子被认为进行了$p杂化,三条杂化轨 道被四个电子占据,其中一条是孤对电子,各有一个电子的另 两条sp杂化轨道与P的sp3杂化轨道生成P一N键;N原子上余下 的被第五个电子占据的p,轨道用于形成π键。磷原子的处于sp杂 化轨道的四个电子近似地按四面体排列在σ键中,这些键分别是 两条P一CI键,两条P一N键,余下的处于d轨道上的第五个电子 用于形成π键。所以在氯代磷腈中的π键是d(P)一p(N)π键
(2) 磷氮化合物(由相互交错的磷原子和氮原子结合而成) ① 低聚合度的氯代磷腈化合物 低聚合度的氯代磷腈化合物(PNCl2 ) n (n=3~8)具有环状结构。 其中以三聚体(PNCl2 ) 3和四聚体(PNCl2 ) 4最为重要。前者为平面形, 后者有“椅式”和“船式”两种构象。 (b) (PNCl2 )4 (a) (PNCl2 )3 P Cl N 在氯代磷腈中,氮原子被认为进行了sp2杂化,三条杂化轨 道被四个电子占据,其中一条是孤对电子,各有一个电子的另 两条sp2杂化轨道与P的sp3杂化轨道生成P-N键;N原子上余下 的被第五个电子占据的pz轨道用于形成键。磷原子的处于sp3杂 化轨道的四个电子近似地按四面体排列在键中,这些键分别是 两条P-Cl键,两条P-N键,余下的处于d轨道上的第五个电子 用于形成键。所以在氯代磷腈中的键是d(P)-p(N) 键