
锦系元素的性质 及其 性质变化规律性 镧系元素在地壳中的丰度和奇偶变化 ©镧系元素的价电子层结构 ©原子半径和离子半径 ©L3+离子的碱度 ●氧化态 ©镧系元素化合物的一些热力学性质 ●镧系元素的光学性质 ©镧系元素的磁学性质 镧系元素的放射性
镧系元素的性质 及其 性质变化规律性 镧系元素在地壳中的丰度和奇偶变化 镧系元素的价电子层结构 原子半径和离子半径 Ln3+离子的碱度 氧化态 镧系元素化合物的一些热力学性质 镧系元素的光学性质 镧系元素的磁学性质 镧系元素的放射性

1镧系元素在地壳中的丰度和奇偶变化 左图显示出镧系元素在地壳中的丰 奇偶变化 度随原子序数的增加而出现奇偶变化的 规律:原子序数为偶数的元素,其丰度 20 总是比紧靠它的原子序数为奇数的大。 除丰度之外,镧系元素的热中子吸 收截面也呈现类似的奇偶变化规律性。 616365676977 原子序数 原子序数是原子核内质子数的代表 系元素地尧丰度随原子序数增如而示出奇偶变化,偶原子序数的元素意味着核内质子数 为偶数。已经知道,核内无论是质子还 是中子,在基态时总以自旋相反配对存在,由于原子序数为偶数 的元素能满足这种自旋相反配对的要求,因而能量较低,所以就 特别稳定,既然该核特别稳定,那么它在地壳中的丰度就大。 稳定的原子核,吸收热中子后仍然很稳定,反之,奇原子序 数的核本身不稳定,吸收热中子后变得更不稳定,所以吸收热中 子的数目有限
1 镧系元素在地壳中的丰度和奇偶变化 是中子,在基态时总以自旋相反配对存在,由于原子序数为偶数 的元素能满足这种自旋相反配对的要求,因而能量较低,所以就 特别稳定,既然该核特别稳定,那么它在地壳中的丰度就大。 稳定的原子核,吸收热中子后仍然很稳定,反之,奇原子序 数的核本身不稳定,吸收热中子后变得更不稳定,所以吸收热中 子的数目有限。 原子序数是原子核内质子数的代表 ,偶原子序数的元素意味着核内质子数 为偶数。已经知道,核内无论是质子还 左图显示出镧系元素在地壳中的丰 度随原子序数的增加而出现奇偶变化的 规律:原子序数为偶数的元素,其丰度 总是比紧靠它的原子序数为奇数的大。 除丰度之外, 镧系元素的热中子吸 收截面也呈现类似的奇偶变化规律性。 奇偶变化
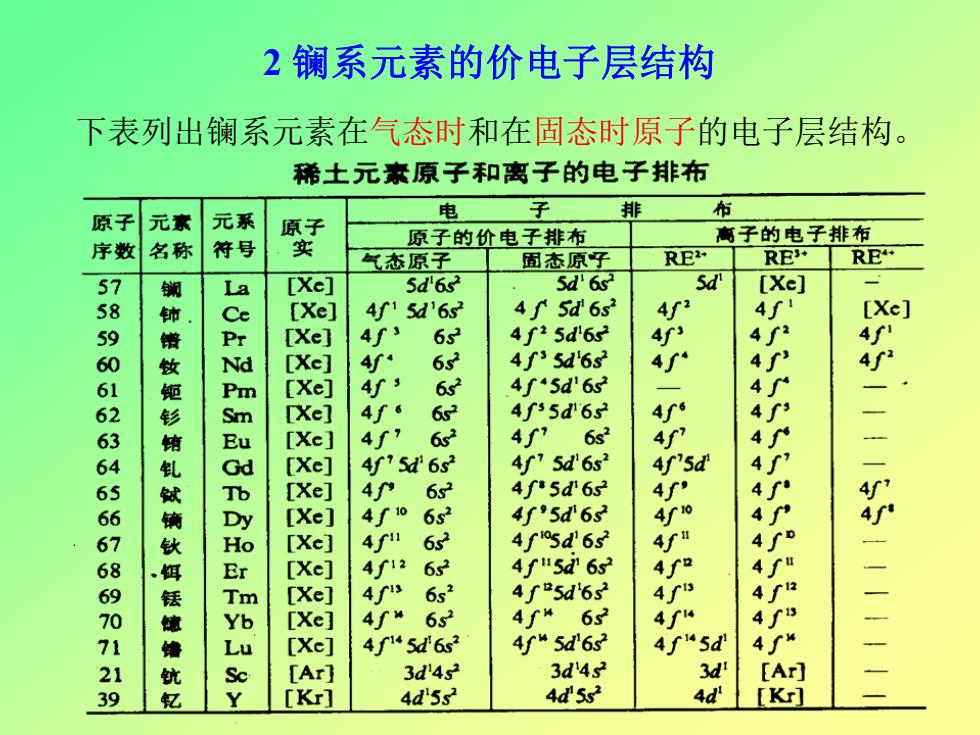
2镧系元素的价电子层结构 下表列出镧系元素在气态时和在固态时原子的电子层结构。 稀土元素原子和离子的电子排布 原子 电 子 排 布 元家 元系 高子的电子排布 序数 名称 符号 实 原子的价电子排布 气态原子 固态原子 RE RE RE [Xe] 5d'6s2 5d'6s sd [Xe] [Xe] 4f15d'6s32 4f 5d'6s 4 4∫ [Xe] [Xe] 4f 632 4f25d'6s 4f2 789066666667860129 [Xe] 4 s2 4f35d6s2 4 [Xe] 4f 6 4f45d'6s2 [Xel 4f6 4f35d6s2 4 [Xe] 4f 6s2 4f76s2 1一二二 [Xe] 4'5d'6s? 4f75d'6s2 4f'5d [Xe] 4 6s2 4f5d63 4∫ [Xe] 652 4f"5d'62 4f0 [Xe] 632 4fsd6s [Xe] 412 6s32 4f5d6s [Xe] 4 6s2 4∫5d6s [Xe] 4∫“ 65 4f“63 4“ [Xe] 4f“5d6s2 4f“5d6s 4f“5d 4∫“ [Ar] 3d'4s2 3d'4s2 3d [Ar] [Kr] 4d5s2 4d'5s2 4d [Kr]
下表列出镧系元素在气态时和在固态时原子的电子层结构。 2 镧系元素的价电子层结构

镧系元素气态原子的 4f轨道的充填呈现两种构 4f-'5d'6s2 型,即4fm-15d6s2和4fm6s2 n2345678/910123本r6s ,这两种电子构型的相对 能量如图1所示: 其中La、Ce、Gd、Lu 图1镧系系元素气态原子基态4-5d6 的基态处于4fm-15d6s2时 与46c2构型的近似相对能量 能量较低,而其余元素皆 为4fm6s2。 La、Gd、Lu的构型可以用P、fP、f4(全空、半满 和全满)的洪特规则来解释,但Ce的结构尚不能得到满 意的解释,有人认为是接近全空的缓故
镧系元素气态原子的 4f轨道的充填呈现两种构 型,即4f n- 15d 16s 2和4f n6s 2 ,这两种电子构型的相对 能量如图1所示: La、Gd、Lu的构型可以用f 0 、f 7 、f 14(全空、半满 和全满)的洪特规则来解释,但Ce的结构尚不能得到满 意的解释,有人认为是接近全空的缓故。 其中 La、Ce、Gd、Lu 的基态处于4fn-15d16s2时 能量较低,而其余元素皆 为4fn6s2

这两种电子结构可以用来说明镧系元素化学性质的差异。 这些元素在参加化学反应时需要失去价电子,由于4f轨道被 外层电子有效地屏蔽着,且由于E4<E5,因而在结构为46s2 的情况下,f电子要参与反应,必须先得由4f轨道跃迁到5d 轨道。这样,由于电子构型不同,所需激发能不同,元素的 化学活泼性就有了差异。 另一方面,激发的结果增加了一个成键电子,成键时可 以多释放出一份成键能。对大多数镧系的原子,其成键能大 于激发能,从而导致4f电子向5d电子跃迁,但少数原子,如 Eu和Yb,由于4f轨道处于半满和全满的稳定状态,要使4f 电子激发必须破坏这种稳定结构,因而所需激发能较大,激发 能高于成键能,电子不容易跃迁,使得Eu、Yb两元素在化学 反应中往往只以6s电子参与反应
这两种电子结构可以用来说明镧系元素化学性质的差异。 这些元素在参加化学反应时需要失去价电子,由于4f 轨道被 外层电子有效地屏蔽着, 且由于E4fE5d , 因而在结构为 4f n6s 2 的情况下, f 电子要参与反应,必须先得由4f 轨道跃迁到5d 轨道。这样,由于电子构型不同,所需激发能不同,元素的 化学活泼性就有了差异。 另一方面,激发的结果增加了一个成键电子,成键时可 以多释放出一份成键能。对大多数镧系的原子,其成键能大 于激发能,从而导致4f 电子向5d 电子跃迁, 但少数原子,如 Eu和Yb,由于4f 轨道处于半满和全满的稳定状态,要使4f 电子激发必须破坏这种稳定结构, 因而所需激发能较大, 激发 能高于成键能, 电子不容易跃迁, 使得Eu、Yb两元素在化学 反应中往往只以6s 2电子参与反应
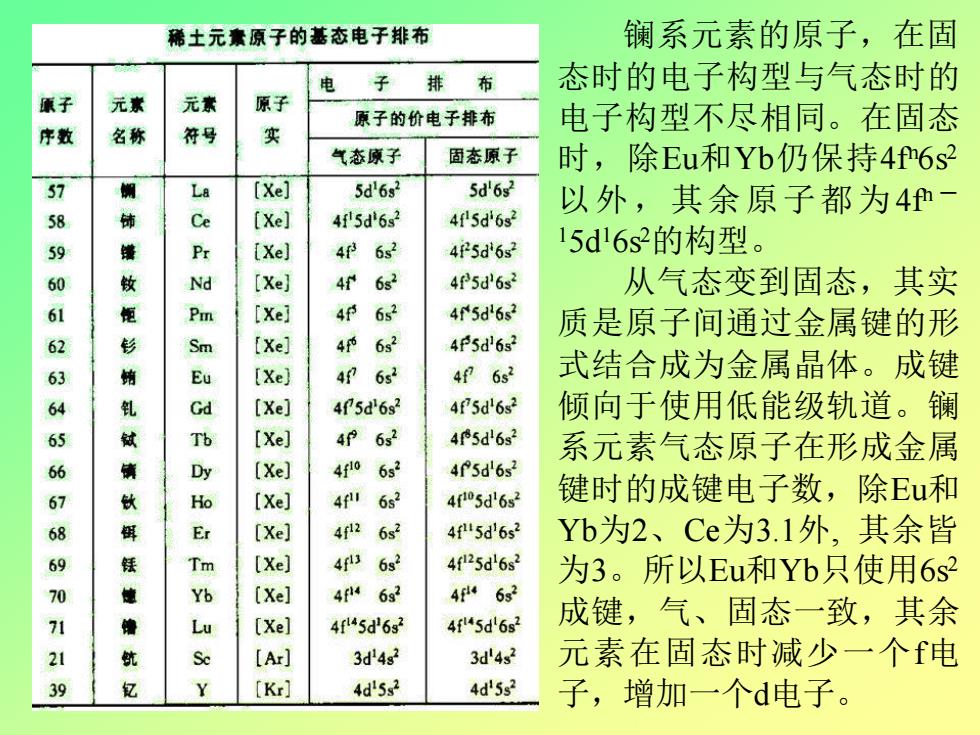
稀土元囊原子的基态电子排布 镧系元素的原子,在固 子 排 布 态时的电子构型与气态时的 元 元 原 原子的价电子排布 电子构型不尽相同。在固态 序数 名称 实 气态原子 固态原子 时,除Eu和Yb仍保持4f6s 5d'6s2 5d'6s2 以外,其余原子都为4 Ce [Xel 415d6s2 45d6s 4f62 45d6s2 15d6s2的构型。 89065456 [Xe] 4f 6s2 4f5d'6s2 从气态变到固态,其实 4P 632 45d'6s2 质是原子间通过金属键的形 4 632 4P5d6s 4f6s2 式结合成为金属晶体。成键 405d'6s2 4f5d'6s2 倾向于使用低能级轨道。镧 62 45d6s2 系元素气态原子在形成金属 4f0 632 4f5d'6s2 4 63 405d'6s2 键时的成键电子数,除Eu和 7890119 4f2 6s2 4f5d'6s2 Yb为2、Ce为3.1外,其余皆 钰健 4 62 4f25d'6s3 为3。所以Eu和Yb只使用6s2 63 46s2 4f45d632 4f5d6s2 成键,气、固态一致,其余 A 3d4g2 3d'4s2 元素在固态时减少一个电 4d'5s2 4d'5s 子,增加一个d电子
镧系元素的原子,在固 态时的电子构型与气态时的 电子构型不尽相同。在固态 时,除Eu和Yb仍保持4f n6s 2 以外,其余原子都为4f n - 15d 16s 2的构型。 从气态变到固态,其实 质是原子间通过金属键的形 式结合成为金属晶体。成键 倾向于使用低能级轨道。镧 系元素气态原子在形成金属 键时的成键电子数,除Eu和 Yb为2、Ce为3.1外, 其余皆 为3。所以Eu和Yb只使用6s 2 成键,气、固态一致,其余 元素在固态时减少一个f电 子,增加一个d电子
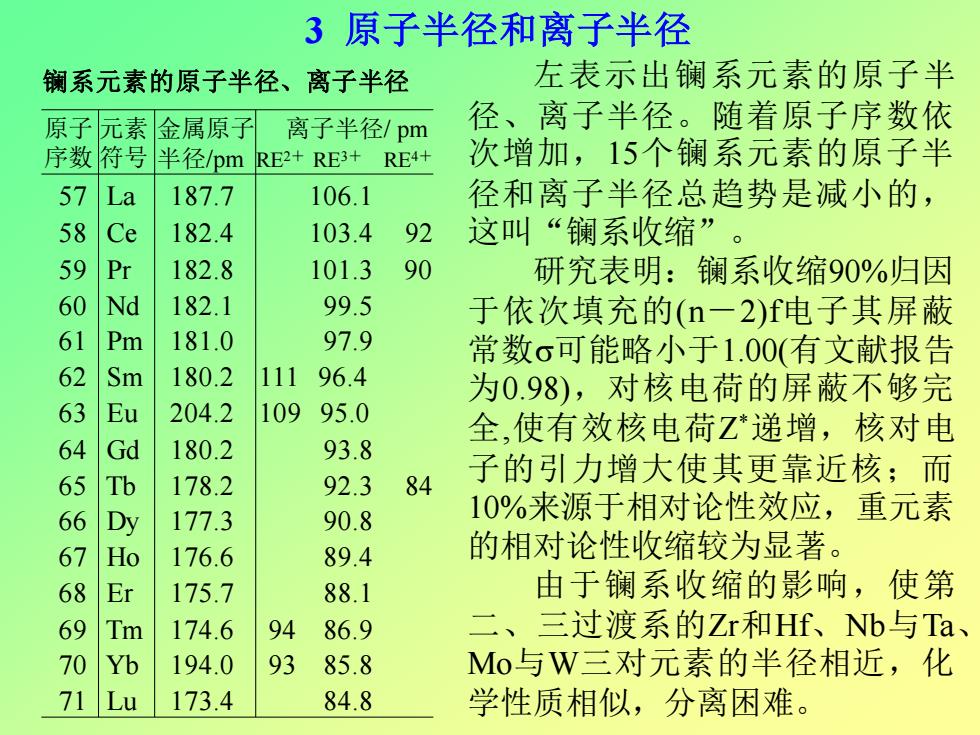
3原子半径和离子半径 镧系元素的原子半径、 离子半径 左表示出镧系元素的原子半 原子元素 金属原子 离子半径/pm 径、离子半径。随着原子序数依 序数符号 半径/pm RE2+RE3+ RE4+ 次增加,15个镧系元素的原子半 57 La 187.7 106.1 径和离子半径总趋势是减小的, 58 Ce 182.4 103.4 92 这叫“镧系收缩”。 59 Pr 182.8 101.3 90 研究表明:镧系收缩90%归因 60 Nd 182.1 99.5 于依次填充的(n一2)f电子其屏蔽 61 Pm 181.0 97.9 常数σ可能略小于1.00(有文献报告 62 Sm 180.2 111 96.4 为0.98),对核电荷的屏蔽不够完 63 204.2 109 95.0 64 d 全,使有效核电荷Z递增,核对电 180.2 93.8 178.2 92.3 84 子的引力增大使其更靠近核;而 66 y 177.3 90.8 10%来源于相对论性效应,重元素 67 176.6 89.4 的相对论性收缩较为显著。 68 E 175.7 88.1 由于镧系收缩的影响,使第 Tm 174.6 94 86.9 、 三过渡系的Zr和Hf、Nb与Ta、 7 Yb 194.0 93 85.8 Mo与W三对元素的半径相近,化 71 Lu 173.4 84.8 学性质相似,分离困难
3 原子半径和离子半径 左表示出镧系元素的原子半 径、离子半径。随着原子序数依 次增加,15个镧系元素的原子半 径和离子半径总趋势是减小的, 这叫“镧系收缩” 。 研究表明:镧系收缩90%归因 于依次填充的(n-2)f电子其屏蔽 常数可能略小于1.00(有文献报告 为0.98),对核电荷的屏蔽不够完 全,使有效核电荷Z *递增,核对电 子的引力增大使其更靠近核;而 10%来源于相对论性效应,重元素 的相对论性收缩较为显著。 由于镧系收缩的影响,使第 二、三过渡系的Zr和Hf、Nb与Ta、 Mo与W三对元素的半径相近,化 学性质相似,分离困难。 57 La 187.7 106.1 58 Ce 182.4 103.4 92 59 Pr 182.8 101.3 90 60 Nd 182.1 99.5 61 Pm 181.0 97.9 62 Sm 180.2 111 96.4 63 Eu 204.2 109 95.0 64 Gd 180.2 93.8 65 Tb 178.2 92.3 84 66 Dy 177.3 90.8 67 Ho 176.6 89.4 68 Er 175.7 88.1 69 Tm 174.6 94 86.9 70 Yb 194.0 93 85.8 71 Lu 173.4 84.8 原子 元素 序数 符号 金属原子 离子半径/ pm 半径/pm RE2+ RE3+ RE4+ 镧系元素的原子半径、离子半径

220 Ba 原子半径 将镧系元素的原子半径随原子序数的变 210 化作图,如左图所示。 20 方面,镧系元素原子半径从La的187.7 190 180 pm到Lu的173.4pm,共缩小了14.3pm,平 s 170 均每两个相邻元素之间缩小14.3/14≈1pm。 尽管平均相差只有1个pm,但其累积效应(共 14pm)是很显著的。另一方面,原子半径不 5759616365676971 原子序数 是单调地减小,而是在Eu和Yb处出现峰和 在Ce处出现谷的现象。这被称为“峰谷效应 ”或“双峰效应”。 除原子半径外,原子体积、密度、原子的热膨胀系数、 第三电离子能、前三个电离能的总和、原子的电负性、一 些化合物的熔点、沸点等也出现这种峰谷效应
将镧系元素的原子半径随原子序数的变 化作图,如左图所示。 一方面, 镧系元素原子半径从La的187.7 pm到Lu的173.4 pm,共缩小了14.3 pm,平 均每两个相邻元素之间缩小14.3/14≈1 pm。 尽管平均相差只有1个pm,但其累积效应(共 14 pm)是很显著的。另一方面,原子半径不 是单调地减小,而是在Eu和Yb处出现峰和 在Ce处出现谷的现象。这被称为“峰谷效应 ”或“双峰效应” 。 原子半径 除原子半径外,原子体积、密度、原子的热膨胀系数、 第三电离子能、前三个电离能的总和、原子的电负性、一 些化合物的熔点、沸点等也出现这种峰谷效应

峰谷效应(双峰效应) 220 Ba 对峰谷效应的解释如下: 210 ●电子精细结构:据计算,Eu、Gd、Yb、Lu 20 的电子精细结构分别为: 190 Eu4f75d0.52626sl121476p0.2591 4180 Gd 4f75d26s' 170 Yb4f45d0.26356s122516p0.,5114 160 Hif. Lu4f45d182356s16p0.1765 5759616365676971 原子序数 由于金属的原子半径与相邻原子之间的电 子云相互重叠(成键作用)程度有关。而Eu和Yb 只用少量d电子参与成键,成键电子总数为2,其他原子(如Gd、 Lu)能使用较多的d电子参与成键,成键电子总数为3(Ce为3.1), 成键作用的差别造成了原子半径的差别。 ●Eu和Yb的碱土性:Eu和Yb在电子结构上与碱土金属十分相 似,这种相似性使得Eu和Yb的物理和化学性能更接近于碱土金属 。其原子半径也接近于碱土金属。 ●洪特规测:Eu和Yb的f电子数分别为f和f4,这种半满和全 满的状态能量低、屏蔽大、有效核电荷小,导致半径增大
由于金属的原子半径与相邻原子之间的电 子云相互重叠(成键作用)程度有关。而Eu和Yb 只用少量 d 电子参与成键,成键电子总数为2,其他原子(如Gd、 Lu)能使用较多的 d 电子参与成键,成键电子总数为3 (Ce为3.1), 成键作用的差别造成了原子半径的差别 。 ●Eu和Yb的碱土性:Eu和Yb在电子结构上与碱土金属十分相 似,这种相似性使得Eu和Yb的物理和化学性能更接近于碱土金属 。其原子半径也接近于碱土金属。 ●洪特规则:Eu和Yb的 f 电子数分别为f 7和f 14 ,这种半满和全 满的状态能量低、屏蔽大、有效核电荷小,导致半径增大。 对峰谷效应的解释如下: ●电子精细结构: 据计算,Eu、Gd、Yb、Lu 的电子精细结构分别为: Eu 4f75d0.52626s1.21476p0.2591 Gd 4f75d26s1 Yb 4f 145d 0.26356s 1.22516p 0.5114 Lu 4f 145d 1.82356s 16p 0.1765 峰谷效应 (双峰效应) Ce Eu Yb

离子半径 110 离子半径 将镧系元素的离子半径随原子序数 的变化作图,如左图所示。 层00 在上述镧系元素离子半径随原子序 Tm" 数变化的图中一方面可以看到,镧系元 配90 素+3价离子从fP的La3+到f4的Lu3+,依 Pr 次增加4f电子(与原子的电子排布不一样 ●Tb ),因而随着原子序数的增加离子的半径 80 5759616365676977 依次单调减小(没有峰谷现象),收缩的 程度比原子半径更大,由La3+的106.1pm 到Lu3+的84.8pm,共缩小了21.3pm,平均每两个相邻元素间 缩小了21.3/14≈1.5pm。这是镧系元素性质的单向变化规律。 另一方面,离子半径的变化,在具有的中点Gd3+钆处, 微有不连续性,这是由于Gd3+具有半满稳定结构,屏蔽稍大 半径略有增大之故。这是镧系元素性质的Gd断效应规律
离子半径 将镧系元素的离子半径随原子序数 的变化作图,如左图所示。 在上述镧系元素离子半径随原子序 数变化的图中一方面可以看到,镧系元 素+3价离子从f 0 的La3+到f 14 的Lu3+ ,依 次增加4f电子(与原子的电子排布不一样 ),因而随着原子序数的增加离子的半径 依次单调减小(没有峰谷现象),收缩的 程度比原子半径更大, 由La3+的106.1 pm 到Lu3+的84.8 pm,共缩小了21.3 pm,平均每两个相邻元素间 缩小了21.3/14≈1.5 pm。这是镧系元素性质的单向变化规律。 另一方面,离子半径的变化,在具有f 7的中点Gd3+钆处, 微有不连续性,这是由于Gd3+具有f 7半满稳定结构, 屏蔽稍大, 半径略有增大之故。这是镧系元素性质的Gd断效应规律。 离子半径