
第九章 d区元素(Ⅲ) 有机金属化合物簇合物 有效原子序数(EAN)规则和金属羰基化合物 类似羰基的有机过渡金属化合物 过渡金属不饱和链烃配合物 过渡金属环多烯化合物 过渡金属的羰基簇化物 过渡金属的卤素簇化物 应用有机过渡金属化合物 和金属原子簇化物的一些催化反应 习题:12w4,o2,7,15;选作题:4,5,68,9,11,12
有效原子序数(EAN)规则和金属羰基化合物 类似羰基的有机过渡金属化合物 过渡金属不饱和链烃配合物 过渡金属环多烯化合物 过渡金属的羰基簇化物 过渡金属的卤素簇化物 应用有机过渡金属化合物 和金属原子簇化物的一些催化反应 习题:1(2),(4),(6),2,7, 15; 选作题:4,5,6,8,9,11,12. d区元素(Ⅲ) ——有机金属化合物 簇合物 第 九 章

9.1金属羰基配合物 9.1.1概述 金属羰基配合物是由过渡金属与配位体 CO所形成的一类配合物。这类配合物无论是 在理论研究还是实际应用上,在近代无机化 学中都占有特殊重要的地位
金属羰基配合物是由过渡金属与配位体 CO所形成的一类配合物。这类配合物无论是 在理论研究还是实际应用上,在近代无机化 学中都占有特殊重要的地位。 9.1 金属羰基配合物 9.1.1 概述

金属羰基配位物有三个特点,即 ①金属与CO之间的化学键很强。如在N(CO)4 中,Ni一C键能为147 kJ.mol一1,这个键能值差不多 与I一I键能(150 kJ-mol-1)和C一0单键键能(142 kmol-1)值相差不多。 ②在这类配合物中,中心原子总是呈现较低的 氧化态(通常为0,有时也呈较低的正氧化态或负氧 化态)。氧化态低使得有可能电子占满dπ一MO,从 而使M→L的π电子转移成为可能。 ③大多数配合物都服从有效原子序数规则
金属羰基配位物有三个特点,即 ① 金属与CO之间的化学键很强。如在Ni(CO)4 中,Ni-C键能为147 kJ·mol-1 ,这个键能值差不多 与I-I键能(150 kJ·mol- 1 )和C-O单键键能(142 kJ·mol-1 )值相差不多。 ② 在这类配合物中,中心原子总是呈现较低的 氧化态(通常为0,有时也呈较低的正氧化态或负氧 化态)。氧化态低使得有可能电子占满d-MO,从 而使M→L的电子转移成为可能。 ③ 大多数配合物都服从有效原子序数规则

最早发现的羰基化合物是N(CO)4,它是在1890 年被Mond发现的。将CO通过还原镍丝,然后再燃烧 ,就发出绿色的光亮火焰(纯净的CO燃烧时发出蓝色 火焰),若使这个气体冷却,则得到一种无色的液体。 若加热这种气体,则分解出N和CO,其反应如下: Ni+4C0常温常压Ni(CO)4(m.p.-25C)△,Ni+4C0 由于Fe、Co、Ni的相似性,它们常常共存。但是 由于金属Co与金属Ni同CO的作用条件不同(Co和Fe必 须在高压下才能与CO化合,N在常温常压就可作用) ,从而利用上述反应就可分离N和C0,以制取高纯度 的Ni
最早发现的羰基化合物是Ni(CO)4,它是在1890 年被Mond发现的。将CO通过还原镍丝,然后再燃烧 ,就发出绿色的光亮火焰(纯净的CO燃烧时发出蓝色 火焰),若使这个气体冷却,则得到一种无色的液体。 若加热这种气体,则分解出Ni和CO,其反应如下: Ni+4CO Ni(CO)4 (m.p.-25℃) Ni+4CO 由于Fe、Co、Ni的相似性,它们常常共存。但是 由于金属Co与金属Ni同CO的作用条件不同(Co和Fe必 须在高压下才能与CO化合,Ni在常温常压就可作用) ,从而利用上述反应就可分离Ni和Co,以制取高纯度 的Ni。 常温常压 △

1891年,Mond还发现C0在493K和2×107Pa 压力下通过还原Fe粉也能比较容易地制得五羰基合 铁Fe(CO)s 493K,20MPa Fe+5CO →Fe(CO)s 继羰基Ni及羰基Fe被发现之后又陆续制得了许 多其他过渡金属羰基配合物,其中一些实例示于下 页表中:
1891年,Mond还发现CO在493 K和2×107 Pa 压力下通过还原Fe粉也能比较容易地制得五羰基合 铁Fe(CO)5。 Fe+5CO Fe(CO)5 继羰基Ni及羰基 Fe 被发现之后又陆续制得了许 多其他过渡金属羰基配合物,其中一些实例示于下 页表中: 493K, 20MPa
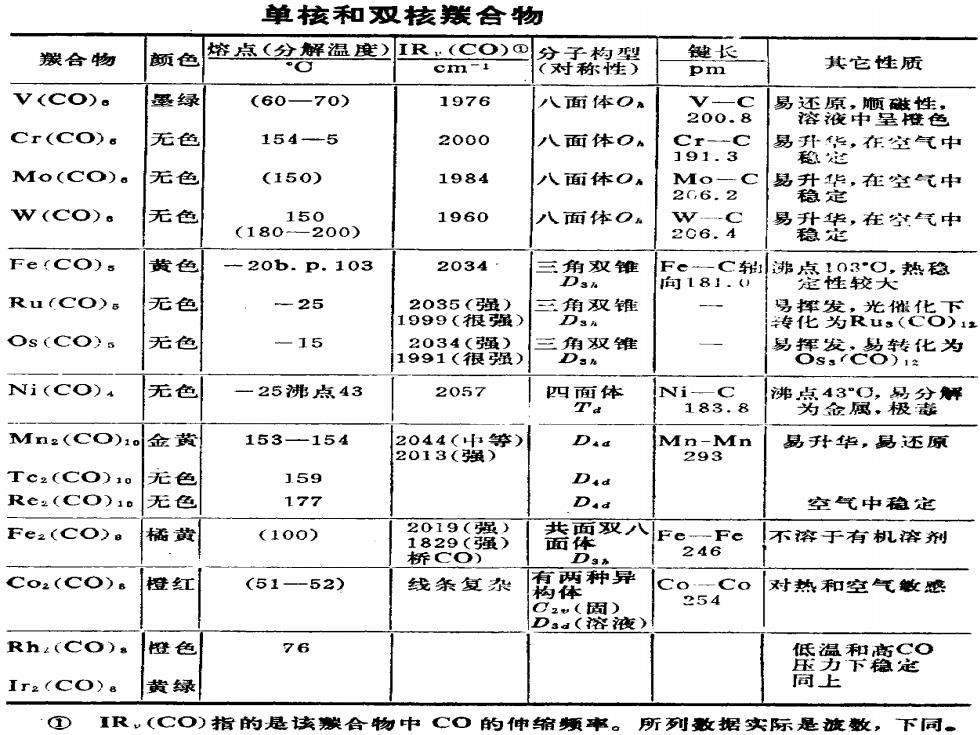
单核和双核猴合物 朕合物 颜色 容点(分解温)IR·(CO)① 键长 cm-i 对称棉罗 pm 其它性质 V(CO). 最绿 (6070) 1976 八面体O V-C 200.8 品老 Cr(Co) 花色 154-5 2000 人面体O Cr-C 191.3 品数意,在空气中 Mo(CO)。 无色 (150) 1984 八面体OA Mo-C 2G,6.2 易升华,在空气中 稳定 W(CO). 无色 15 1960 八面体O。 W-C (180 200) 易升华,在空气中 206.4 稳地 Fe(Co). 黄色 -20b.p.103 2034 三三角议维 局8C谛毫耀较头热稳 向181.) Ru(CO)s 无色 -25 2035(强) 三角双锥 1999(很强) 接托爹光继毡下 Os(COS 无色 -15 2034(虽) 三角双维 1991(很强) Dan 易器总化为 Ni(CO) 无色 一25沸点43 2057 四面体 Ni-C 183.8 沸务品凤:粮盆解 Mn2(CO)1. 金黄 153-154 2044(中等) Dad Mn-Mn 易孙华,易还原 2013(强) 293 Tc2(CO)10 无色 159 Did Re.(CO)10 无色 177 D.a 空气中稳定 Fe2(CO> 橘黄 (100) 2019(强) 1829(强) 共面双八Fe,Fe 面体 不溶于有肌容剂 桥C○) 246 Co2(CO) 橙雉江 (51-52) 线条复 两种异 构 Co-Co 对热和空气敏感 254 C2() Dsa(容液) Rha(CO) 橙色 76 低温和高C© 拉力下起 Ir2(CO)& 黄绿 同上 ① IR,(CO)指的是该碳合物中CO的伸缩烦率。 所列收据实际是波数, 下同

9.1.3有效原子序数规则(EAN规则) 1EAN规则 EAN规则是说金属的d电子数加上配体所提供的σ 电子数之和等于18或等于最邻近的下一个稀有气体原子 的价电子数,或中心金属的总电子数等于下一个稀有气 体原子的有效原子序数。 EAN亦称为18电子规则,这个规则实际上是金属 原子与配体成键时倾向于尽可能完全使用它的九条价轨 道(五条d轨道、一条s、三条p轨道)的表现
1 EAN规则 EAN规则是说金属的d电子数加上配体所提供的σ 电子数之和等于18或等于最邻近的下一个稀有气体原子 的价电子数, 或中心金属的总电子数等于下一个稀有气 体原子的有效原子序数。 EAN亦称为18电子规则,这个规则实际上是金属 原子与配体成键时倾向于尽可能完全使用它的九条价轨 道(五条d轨道、一条s、三条p轨道)的表现。 9.1.3 有效原子序数规则(EAN规则)

需要指出的是,有些时候,它不是18而是 I6。这是因为18e意味着全部s、p、d价轨道都被利用 ,当金属外面电子过多,意味着负电荷累积,此时假定 能以反馈键M→L形式将负电荷转移至配体,则18e结 构配合物稳定性较强;如果配体生成反馈键的能力较 弱,不能从金属原子上移去很多的电子云密度时,则 形成16电子结构配合物。 因此,EAN规则在有些书上直接叫18e和 16e规则。 注意:这个规则仅是一个经验规则,不是化学键 的理论
需要指出的是,有些时候,它不是18而是 16。这是因为18e意味着全部s、p、d价轨道都被利用 ,当金属外面电子过多,意味着负电荷累积, 此时假定 能以反馈键M→L形式将负电荷转移至配体,则18e结 构配合物稳定性较强;如果配体生成反馈键的能力较 弱,不能从金属原子上移去很多的电子云密度时,则 形成16电子结构配合物。 因此,EAN规则在有些书上直接叫18e和 16e规则。 注意:这个规则仅是一个经验规则,不是化学键 的理论

举例说明18e规则和如何确定电子的方法: ①把配合物看成是给体一受体的加合物,配体给 予电子,金属接受电子; ②对于经典单齿配体,如胺、膦、卤离子、CO、 H一、烷基R-和芳基Ar一,都看作是二电子给予体。 如 Fe(CO)4H2 Ni(CO)4 Fe2+ 6 Ni 10 4C04X2=8 +)4C04×2=8 +)2H-2×2=4 10+8=18 6+8+4=18
举例说明18e规则和如何确定电子的方法: ① 把配合物看成是给体-受体的加合物,配体给 予电子,金属接受电子; ② 对于经典单齿配体, 如胺、膦、卤离子、CO、 H-、烷基R-和芳基Ar-,都看作是二电子给予体。 如 Fe(CO)4H2 Ni(CO)4 Fe2+ 6 Ni 10 4CO 4×2=8 +)4CO 4×2=8 +)2H- 2×2=4 10+8=18 6+8+4=18

③在配合阴离子或配合阳离子的情况下,规定把离子的电 荷算在金属上。如: Mn(C0)6+:Mn+7-1=6,6C06×2=12,6+12=18 C0(C0)4-:C0-9+1=10,4C04×2=8,10+8=18 ④ 对NO等三电子配体: Mn(CO)NO) NO 3, 4C0 8, +)Mn 7, 3+8+7=18
③ 在配合阴离子或配合阳离子的情况下,规定把离子的电 荷算在金属上。如: Mn(CO)6 +: Mn+ 7-1=6, 6CO 6×2=12, 6+12=18 Co(CO)4 -: Co- 9+1=10, 4CO 4×2=8, 10+8=18 ④ 对NO等三电子配体: Mn(CO)4 (NO) NO 3, 4CO 8, +) Mn 7, 3+8+7=18