
第十幸 f区过渡元素
第十章 f 区过渡元素

基本要求 1镧系和稀土 价电子层结构、原子和离子半径、L3+离子的碱度、 镧系离子的分离 2镧系原子的一些性质 各氧化态物种的稳定性 光学性质 镧系离子的电子能级,镧系离子的电子光谱和颜色, 镧系离子的超灵敏跃迁,镧系激光,镧系荧光 磁学性质 放射性 3镧系元素性质递变的规律性 单向变化,Gd断效应,双峰效应,奇偶变化,周期性变 化,三分组效应,四分组效应,双一双效应,斜W效应 4配合物 电子的配位场效应,配合物的特点 5锕系元素的一般性概貌 习题:12.4,u6,2,45,62.4.6.87,9,13
基 本 要 求 1 镧系和稀土 价电子层结构、原子和离子半径、Ln3+离子的碱度、 镧系离子的分离 2 镧系原子的一些性质 各氧化态物种的稳定性 光学性质 镧系离子的电子能级,镧系离子的电子光谱和颜色, 镧系离子的超灵敏跃迁,镧系激光,镧系荧光 磁学性质 放射性 3 镧系元素性质递变的规律性 单向变化,Gd断效应,双峰效应,奇偶变化,周期性变 化,三分组效应,四分组效应,双-双效应,斜W效应 4 配合物 f电子的配位场效应,配合物的特点 5 锕系元素的一般性概貌 习题:1(2),(4),(6),2,4,5,6(2),(4),(6),(8),7,9,13
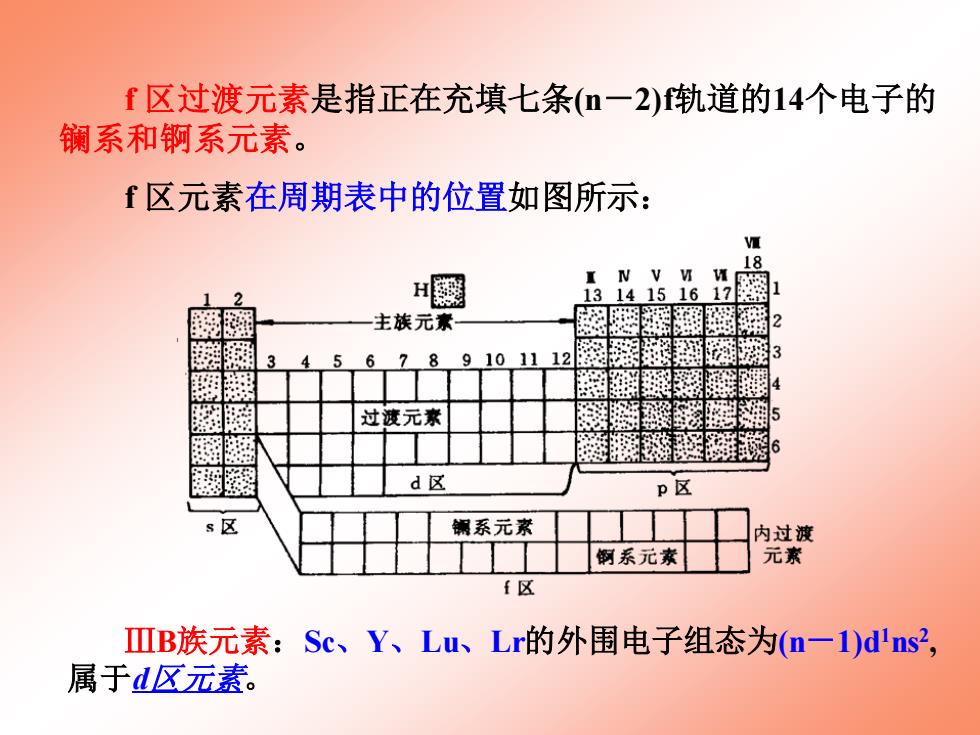
f区过渡元素是指正在充填七条(m一2)轨道的14个电子的 镧系和锕系元素。 「区元素在周期表中的位置如图所示: 18 H慰 1314151617 主族元素 摇 2 6 78 9101112 3 过渡元素 5 d区 P区 s区 锅系元素 内过渡 倒系元素 元素 f区 ⅢB族元素:Sc、Y、Lu、Lr的外围电子组态为(n一1)d'ns2, 属于d区元素
ⅢB族元素:Sc、Y、Lu、Lr的外围电子组态为(n-1)d1ns2 , 属于d区元素。 f 区过渡元素是指正在充填七条(n-2)f轨道的14个电子的 镧系和锕系元素。 f 区元素在周期表中的位置如图所示:

10.1概述 镧系元素和锕系元素 习惯上所称的镧系元素是指从s7La一1Lu的15个元素,以 Ln表示。本来镧系元素并不包括Lu,将它归在一起是因Lu与其 前面的从s7La到0Yb的14个填充4f轨道电子的元素的性质非常相 似。 同样,Lr与其前面的g9Ac到1o2No的14个填充5f轨道电子的 元素性质也非常相似,因而在习惯上也把从89Ac到13Lr的15个 元素统称为锕系元素,记作An,按理锕系元素并不包括Lr。 把镧系和锕系放在周期表的外面是为了不让它们破坏周期 表一格一元素的规律。 由于镧系元素和锕系元素最后填入的电子都是填充在外数 第三层的电子亚层,所以人们把它们统称为内过渡元素。称镧 系元素为第一内过渡系,锕系元素为第二内过渡系
习惯上所称的镧系元素是指从57La-71Lu的15个元素,以 Ln表示。本来镧系元素并不包括Lu, 将它归在一起是因Lu与其 前面的从57La到70Yb的14个填充4f轨道电子的元素的性质非常相 似。 同样,Lr与其前面的89Ac到102No的14个填充5f轨道电子的 元素性质也非常相似,因而在习惯上也把从89Ac到103Lr的15个 元素统称为锕系元素,记作An,按理锕系元素并不包括Lr。 把镧系和锕系放在周期表的外面是为了不让它们破坏周期 表一格一元素的规律。 由于镧系元素和锕系元素最后填入的电子都是填充在外数 第三层的f电子亚层,所以人们把它们统称为内过渡元素。称镧 系元素为第一内过渡系,锕系元素为第二内过渡系。 10.1 概述 镧系元素和锕系元素

镧系与稀土 稀土元素包括Sc、Y和La系共17个元素。其中的Sc,同其 余16个元素相比,由于其离子半径小,性质差别大,在自然界 有自己的矿物,不和稀土共生,在性质上与A更为接近。而Y 的三价离子半径(89.3pm)与Ho3+离子半径(89.4pm)接近,无论 在物理性质和化学性质上都非常类似于镧系元素,在自然界常 与稀土共生。 “稀土”这是历史上遗留下来的名词,其实稀土并不“稀 ”, 只是由于这些元素在地壳中分布分散,提取、分离都较困 难,人们对它们的系统研究开始较晚之故。 为了研究方例,人们常将稀土元素分成组,按照它们的电 子层结构、离子半径以及由此反映的物理、化学性质,将从 La→Eu七个元素称为“轻稀土”或铈组稀土,把从Gd→Lu(包 括Sc、Y)叫作“重稀土”或钇组稀土(但这种划分不是严格的, 分离工艺不同,分法也不同)
稀土元素包括Sc、Y和La系共17个元素。其中的Sc,同其 余16个元素相比,由于其离子半径小,性质差别大,在自然界 有自己的矿物,不和稀土共生,在性质上与Al更为接近。而Y 的三价离子半径(89.3pm)与Ho3+离子半径(89.4pm)接近,无论 在物理性质和化学性质上都非常类似于镧系元素,在自然界常 与稀土共生。 “稀土”这是历史上遗留下来的名词,其实稀土并不“稀 ” ,只是由于这些元素在地壳中分布分散,提取、分离都较困 难,人们对它们的系统研究开始较晚之故。 为了研究方例,人们常将稀土元素分成组,按照它们的电 子层结构、离子半径以及由此反映的物理、化学性质,将从 La→Eu七个元素称为“轻稀土”或铈组稀土,把从Gd→Lu(包 括Sc、Y)叫作“重稀土”或钇组稀土(但这种划分不是严格的, 分离工艺不同,分法也不同)。 镧系与稀土
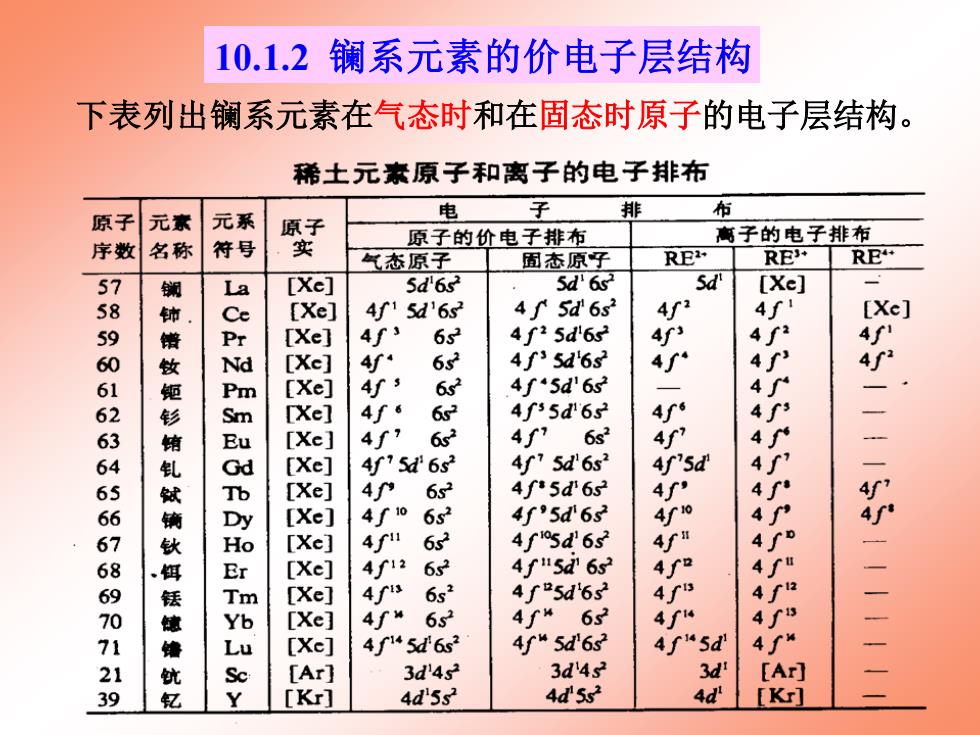
10.1.2镧系元素的价电子层结构 下表列出镧系元素在气态时和在固态时原子的电子层结构。 稀土元素原子和离子的电子排布 布 原子 元素 元系 电 子 排 高子的电子排布 序数 名称 符号 实 原子的价电子排布 气态原子 固态原子 RE RE RE La [Xe] 5d'6s2 5d'6s Sdi [Xe] [Xe] 4f15d'6s32 4f 5d'6s 4f2 4∫ [Xe] [Xe] 4f、 62 4f25d6s2 4f' 4f2 768906066666676860129 [Xe] 4 632 4f35d6s2 4∫ [Xe] 4j3 6 4f'5d'6s [Xel 4f6 6s2 4f35d'6s2 4r6 [Xe] 4∫7 6s2 4f 6s2 4 9二二二 [Xe] 4f'5d'6s 4f75d6s2 4f'sd [Xe] 49 6s2 4f5d'6s2 4 [Xe] 6s2 4f'5d'62 0 [Xe] 6s2 4f0sd6s 4 [Xe] 4f12 6s2 4∫"5d6s [Xe] 4is 6s2 4∫5d6s2 [Xe] 4∫“ 65 4f“632 4f4 4 [Xe] 4f1*5d6s2 4f“5d6s 4∫“5d 4∫ [Ar] 3d'4s2 3d4s2 3d [A] [K] 4d5s2 4d5s2 4d [Kr]
下表列出镧系元素在气态时和在固态时原子的电子层结构。 10.1.2 镧系元素的价电子层结构

镧系元素气态原子的 4轨道的充填呈现两种构 4-'5d6s2 型,即4fm-15d6s2和4fm6s2 a方456789i02的 这两种电子构型的相对 能量如图1所示: 其中La、Ce、Gd、Lu 图1镧系系元素气态原子基态4-5d6s2 的基态处于4fm-15d6s2时 与46c构型的近似相对能量 能量较低,而其余元素皆 为4fm6s2。 La、Gd、Lu的构型可以用f0、f7、f4(全空、半 满和全满)的洪特规则来解释,但Ce的结构尚不能得到 满意的解释,有人认为是接近全空的缓故
镧系元素气态原子的 4f轨道的充填呈现两种构 型,即4f n- 15d 16s 2和4f n6s 2 ,这两种电子构型的相对 能量如图1所示: La、Gd、Lu的构型可以用f 0 、f 7 、f 14(全空、半 满和全满)的洪特规则来解释,但Ce的结构尚不能得到 满意的解释,有人认为是接近全空的缓故。 其中 La、Ce、Gd、Lu 的基态处于4fn-15d16s2时 能量较低,而其余元素皆 为4fn6s2

这两种电子结构可以用来说明镧系元素化学性质的 差异。这些元素在参加化学反应时需要失去价电子,由 于4f轨道被外层电子有效地屏蔽着,且由于E4<Es,因而 在结构为46s2的情况下,f电子要参与反应,必须先得由 4f轨道跃迁到5d轨道。这样,由于电子构型不同,所需 激发能不同,元素的化学活泼性就有了差异。 另一方面,激发的结果增加了一个成键电子,成键 时可以多释放出一份成键能。对大多数镧系的原子,其 成键能大于激发能,从而导致4f电子向5d电子跃迁,但 少数原子,如Eu和Yb,由于4f轨道处于半满和全满的稳 定状态,要使4f电子激发必须破坏这种稳定结构,因而所 需激发能较大,激发能高于成键能,电子不容易跃迁,使得 Eu、Yb两元素在化学反应中往往只以6s2电子参与反应
这两种电子结构可以用来说明镧系元素化学性质的 差异。这些元素在参加化学反应时需要失去价电子,由 于4f 轨道被外层电子有效地屏蔽着, 且由于 E4fE5d , 因而 在结构为 4f n6s 2的情况下, f 电子要参与反应,必须先得由 4f 轨道跃迁到 5d 轨道。这样,由于电子构型不同,所需 激发能不同,元素的化学活泼性就有了差异。 另一方面,激发的结果增加了一个成键电子,成键 时可以多释放出一份成键能。对大多数镧系的原子,其 成键能大于激发能,从而导致 4f 电子向 5d 电子跃迁,但 少数原子,如Eu和Yb,由于 4f 轨道处于半满和全满的稳 定状态,要使 4f 电子激发必须破坏这种稳定结构, 因而所 需激发能较大, 激发能高于成键能, 电子不容易跃迁, 使得 Eu、Yb两元素在化学反应中往往只以 6s 2 电子参与反应

镧系元素在固态时的电子构型与气态时的电子构型 不尽相同,除Eu和Yb仍保持4f6s2以外,其余原子都为 4fm-15d6s2的构型。 从气态变到固态,其实质是原子间通过金属键的形 式结合成为金属晶体。这个过程就是价层轨道的重叠过 程。实验表明,镧系元素在形成金属键时的成键电子数, 除Eu和Yb为2、Ce为3.1外,其余皆为3。这正好验证了刚 才我们的推测
镧系元素在固态时的电子构型与气态时的电子构型 不尽相同,除Eu和Yb仍保持4f n6s 2以外,其余原子都为 4f n-15d 16s 2的构型。 从气态变到固态,其实质是原子间通过金属键的形 式结合成为金属晶体。这个过程就是价层轨道的重叠过 程。实验表明,镧系元素在形成金属键时的成键电子数, 除Eu和Yb为2、Ce为3.1外,其余皆为3。这正好验证了刚 才我们的推测

10.1.3原子半径和离子半径 随着原子序数依次增加,15个镧系元素的原子半径和 离子半径总趋势是减小的,这叫“镧系收缩”。 研究表明:镧系收缩90%归因于依次填充的(n一2)f 电子其屏蔽常数o可能略小于1.00(有文献报告为0.98),对 核电荷的屏蔽不够完全,使有效核电荷Z*递增,核对电子 的引力增大使其更靠近核;而10%来源于相对论性效应, 重元素的相对论性收缩较为显著。 由于镧系收缩的影响,使第二、三过渡系的Zr和Hf、 Nb与Ta、Mo与W三对元素的半径相近,化学性质相似, 分离困难
10.1.3 原子半径和离子半径 随着原子序数依次增加,15个镧系元素的原子半径和 离子半径总趋势是减小的,这叫“镧系收缩” 。 研究表明:镧系收缩90%归因于依次填充的(n-2)f 电子其屏蔽常数 可能略小于1.00(有文献报告为0.98),对 核电荷的屏蔽不够完全,使有效核电荷Z* 递增,核对电子 的引力增大使其更靠近核;而10%来源于相对论性效应, 重元素的相对论性收缩较为显著。 由于镧系收缩的影响,使第二、三过渡系的Zr和Hf、 Nb与Ta、Mo与W三对元素的半径相近,化学性质相似, 分离困难