
第八章d区元素 叙述化学 过渡元素的一般定义及其分类 d轨道的特征和过渡元素的价电子结构 I第一过渡系的元素的化学 单质和化合物制备自由能一温度图 元素氧化态及物种的特征和分布自由能一氧化态图 元素的化学及其d电子构型分类电势一pH图 Ⅱ重过渡元素的化学 特点存在与制备金属的性质和用途 主要氧化态及其简单化合物配合物 铂系金属 特点配合物应用 习题 1、3)、5、(八9、12?2,4,52、4、⑥、8 13,14,15,16170
过渡元素的一般定义及其分类 d轨道的特征和过渡元素的价电子结构 Ⅰ 第一过渡系的元素的化学 单质和化合物制备 自由能-温度图 元素氧化态及物种的特征和分布 自由能-氧化态图 元素的化学及其d电子构型分类 电势-pH图 Ⅱ 重过渡元素的化学 特点 存在与制备金属的性质和用途 主要氧化态及其简单化合物配合物 铂系金属 特点 配合物 应用 第八章 d区元素 ——叙述化学 习题 1(1)、(3)、(5)、(7)、(9)、(12),2,4,5(2)、(4)、(6)、(8), 13,14,15,16, 17(1)

7.1过渡元素 1定义 ●最早的过渡元素是指第Ⅷ族元素。 这是因为过去多使用短式周期表,在短表中,第4、5、 6长周期各占两个横行,第Ⅷ族处于由第一个横行向第二 个横行的“过渡”区域。其特点是横向相似,即第四周期 的Fe、Co、Ni相似,组成了Fe系元素。第五周期的Ru、 Rh、Pd,第六周期的Os、Ir、Pt两组横向相似,称之为 铂系元素
7.1 过渡元素 1 定义 ●最早的过渡元素是指第Ⅷ族元素。 这是因为过去多使用短式周期表,在短表中,第4、5、 6长周期各占两个横行,第Ⅷ族处于由第一个横行向第二 个横行的“过渡”区域。其特点是横向相似,即第四周期 的Fe、Co、Ni相似,组成了Fe系元素。第五周期的Ru、 Rh、Pd,第六周期的Os、Ir、Pt两组横向相似,称之为 铂系元素
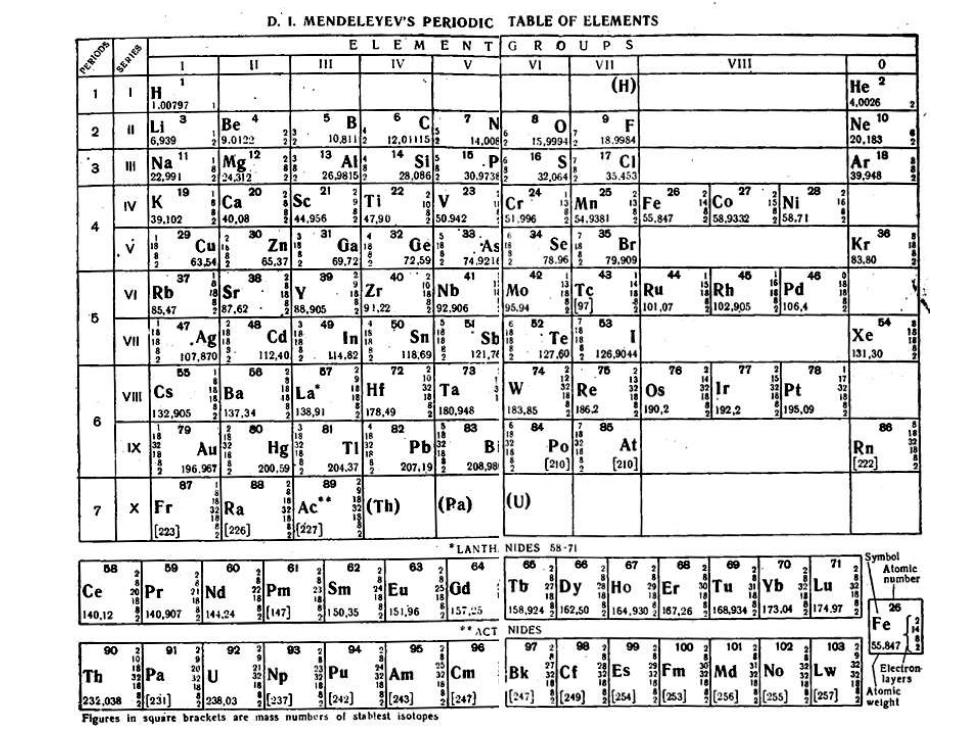
D.I.MENDELEYEV'S PERIODIC TABLE OF ELEMENTS E L E M E N TG R O U P S 1 n IV VI VII VilI 0 1 (H) He 4.0026 4 6 C 2 L13 Be 7 N 80 F Ne 6.939 29.0122 10.813 2.015月 14.00E 15999H 18.9984 20.183 3 用 Na iT 18 8 13A 14 16.P 16S 22.991 24.312 26.9815 28 30.973 32.064 35.45 K 19 20 23 25 26 27 28 Ca Sc Ti 24 Cr Mn Fe 24 Co Ni .102 40.08 44956 47.90 50942 51.99% 54.9381 65.847 58.9332 58.71 4 29 21682 30 35 Cu 10 3 32 83 34 Ge 7 As Se Br Kr 6354 65.37 69.72 72,59 5162 74921t 78.96 79.909 83.80 37 3 89 41 40 43 46 Rb 88 Y Zr Nb Mo Ru Pd 97 Rh 02,905 106.4 888 85.7 288.905 9122 92.906 95.94 101.07 47 48 40 48 0 62 分 64 Ag Cd Sn Sb Te Xe 107,870 112,40 .114.82 118.69 ! 121.70 127.60 12604 13130 68 67 72 73 7 76 77 Cs Ba 288 La Hf 202 Ta Re 42 Pt 132.905 137,34 138.91 178.49 180.948 183.85 1852 1902 1922 195.09 6 19 80 3 4826? 83 86 Au Hg B Po At 196.967 22662 288 200.59 204.37 207,19 208.98 [210] [2101 [222] 2 89 Ra Ac Th) (Pa) [223] [226] *LANTH NIDES 58-71 Symbol 60 61 62 63 64 60 68 67 69 69 70 分 Ce Pr Nd Pm Sm 848 Eu 2821 Gd Tb 28278 Dy Ho Er b 140.12 140.907 144.24 47] 150.35 151.96 575 158.924 162.50 164.930 87.26 168934 173.04 174.97 ACT NIDES 92 03 94 96 的 97 号 102 103 847 Th Pa Np Pu 数Am Cm Bk Cf Es m Md No W 92 23.038.g[23 238,03 237] 23 (247) [249 254 253 256 955 2571 Flgures in squire brackets are mass numbers of stablest isotopes

VI 18 1 IV V VI VII 1 2 131415 1617 1 2 IIIBIVBV BVIBVIB.ⅧB IBIIB 345 678910 1112 3 4 5 6 7 8 9 镧系元素 铜系元素 超锕系元素 T 新超锕系元素
超 新超 ⅢBⅣBⅤBⅥBⅦB ⅧB IBIIB

目前人们对过渡元素的认识并不一致。 现在,对“过渡元素”概念上的理解,大体有如下三种: ●认为“过渡元素”是指从IB一ⅧB族的元素,即除了Cu Z副族外的所有副族,共8个竖行,其原子的电子结构特点是有 未充满的d电子亚层。电子构型为(n一1)d1-9nsl-2。 ●认为“过渡元素”是指从IB一B族的元素,包括Cu副族 (不包括Z副族),共9个竖行,其原子的电子结构特点是原子及 其重要的氧化态有未充满的d亚层,电子构型是(n一1)d-10nsl-2。 ●认为“过渡元素”是指从IB一ⅡB的全部副族元素,共 10个竖行。在这种划分中,“过渡”的含义是指从金属元素到 非金属元素的过渡或由周期表s区元素过渡到区元素,电子构 型为(n-1)d1-10ns2
目前人们对过渡元素的认识并不一致。 现在,对“过渡元素”概念上的理解,大体有如下三种: ●认为“过渡元素”是指从ⅢB-ⅧB族的元素,即除了Cu、 Zn副族外的所有副族,共 8个竖行,其原子的电子结构特点是有 未充满的d电子亚层。电子构型为(n-1)d1-9ns1-2 。 ●认为“过渡元素”是指从ⅢB-IB族的元素,包括Cu副族 (不包括Zn副族),共9个竖行,其原子的电子结构特点是原子及 其重要的氧化态有未充满的d亚层,电子构型是(n-1)d1-10ns1-2 。 ●认为“过渡元素”是指从ⅢB-IIB的全部副族元素,共 10个竖行。在这种划分中, “过渡” 的含义是指从金属元素到 非金属元素的过渡或由周期表 s区元素过渡到 p区元素,电子构 型为 (n-1)d1-10ns2

对“过渡元素”产生这几种不同的认识,其原因是BCu副 族、BZ副族有不同于其他副族元素的“独特”性质。 其实这种情况B族元素也有。 目前的这三种定义各有道理,第一种完全与周期表区元素 一致,第二种抓住了元素的化学性质的共同特征的本质,第三 种说明由金属到非金属的过渡的变化规律。因此,对于过渡元 素的定义,最好不要局限王仕么形式,而是看你过论问题的密 要而定。若是从宏观上讨论元素的性质变化规律,此时为了进 行对比,列出的性质中当然应该包括B、B元素的性质
其实这种情况ⅢB族元素也有。 对“过渡元素”产生这几种不同的认识,其原因是IB Cu副 族、IIB Zn副族有不同于其他副族元素的“独特”性质。 目前的这三种定义各有道理,第一种完全与周期表d区元素 一致,第二种抓住了元素的化学性质的共同特征的本质,第三 种说明由金属到非金属的过渡的变化规律。因此,对于过渡元 素的定义,最好不要局限于什么形式,而是看你讨论问题的需 要而定。若是从宏观上讨论元素的性质变化规律,此时为了进 行对比,列出的性质中当然应该包括IB、IIB元素的性质

2分类 为了讨论的方便,可以根据过渡元素的综合化学性质进行分类: ●前过渡元素,IVB一VIIB,不包括Mn,位于d区的前部, 其特征是其高价离子在水溶液中常发生聚合作用。 ●Mn到Cu,后过渡元素,第一过渡系的后部,其特点是以 水溶液化学和配位化学为其特征。 ●Ru、Rh、Pd,Os、Ir、Pt,再加上Ag、Au,称为贵金属 元素,特征也是丰富的配位化学。 ●第一过渡系称为轻过渡元素; ●第二、三过渡系,称为重过渡元素。 ★第一、第二和第三过渡系总称为“主过渡元素 ★区元素称为“内过遮元麦
★第一、第二和第三过渡系总称为“主过渡元素 ”; ★f区元素称为“内过渡元素” 。 2 分类 为了讨论的方便,可以根据过渡元素的综合化学性质进行分类: ●前过渡元素,IVB-VIIB,不包括Mn,位于d区的前部, 其特征是其高价离子在水溶液中常发生聚合作用。 ●Mn到Cu,后过渡元素,第一过渡系的后部,其特点是以 水溶液化学和配位化学为其特征。 ●Ru、Rh、Pd,Os、Ir、Pt,再加上Ag、Au,称为贵金属 元素,特征也是丰富的配位化学。 ●第一过渡系称为轻过渡元素; ●第二、三过渡系,称为重过渡元素

7.2d轨道的特征和过渡元素的 价电子层结构 d区过渡元素有许多不同于s区、p区和f区元素的特性: 如★离子多有颜色; ★多变价, ★易形成配合物; ★大多数化合物都有顺磁性等。 这些特性主要归功于d轨道参与成键 因此,在某种程度上来说: 过渡元素的化学就是轨道的化学
7.2 d轨道的特征和过渡元素的 价电子层结构 这些特性主要归功于d轨道参与成键 d区过渡元素有许多不同于s区、p区和f区元素的特性: 如 ★离子多有颜色; ★多变价; ★易形成配合物; ★大多数化合物都有顺磁性等。 过渡元素的化学就是d轨道的化学。 因此,在某种程度上来说:

7.2.1d轨道的特征 1d轨道比s、p轨道的数目多,成键可能性大; 2(n一1)d轨道的能量与ns、np接近,是易参与成键的内层轨道。 据实验测定发现,(n-l)d与ns或np轨道的能量差远较主族元素 的ns与np轨道的能量差小得多。 3d轨道在空间的取向和角度分布 五条d轨道的角度函数按其极大值在空间的分布可分为两组, 一 组在轴上,包括d2、d2y2,另一组在轴间夹角45°线上,包括 dy、dxz dyzo d轨道都有对称中心,是偶函数,具有g对称性。 4d电子的几率径向分布函数 电子的几率径向分布曲线,其峰的个数为(n-),显然d轨道比 同层的s、p轨道的峰的数目要少,因而钻到原子核附近的几率小, 相应的能量较高,因而造成了能级交错现象,使En-1)d>Es
电子的几率径向分布曲线,其峰的个数为(n-l),显然d轨道比 同层的s、p轨道的峰的数目要少,因而钻到原子核附近的几率小, 相应的能量较高,因而造成了能级交错现象,使E(n-1)d>Ens。 7.2.1 d轨道的特征 1 d轨道比s、p轨道的数目多,成键可能性大; 据实验测定发现,(n-1)d与ns或np轨道的能量差远较主族元素 的ns与np轨道的能量差小得多。 五条d 轨道的角度函数按其极大值在空间的分布可分为两组, 一组在轴上,包括dz 2、dx 2-y 2,另一组在轴间夹角45°线上,包括 dxy、dxz、dyz。 d 轨道都有对称中心,是偶函数,具有g对称性。 4 d电子的几率径向分布函数 3 d轨道在空间的取向和角度分布 2 (n-1)d轨道的能量与ns、np接近,是易参与成键的内层轨道
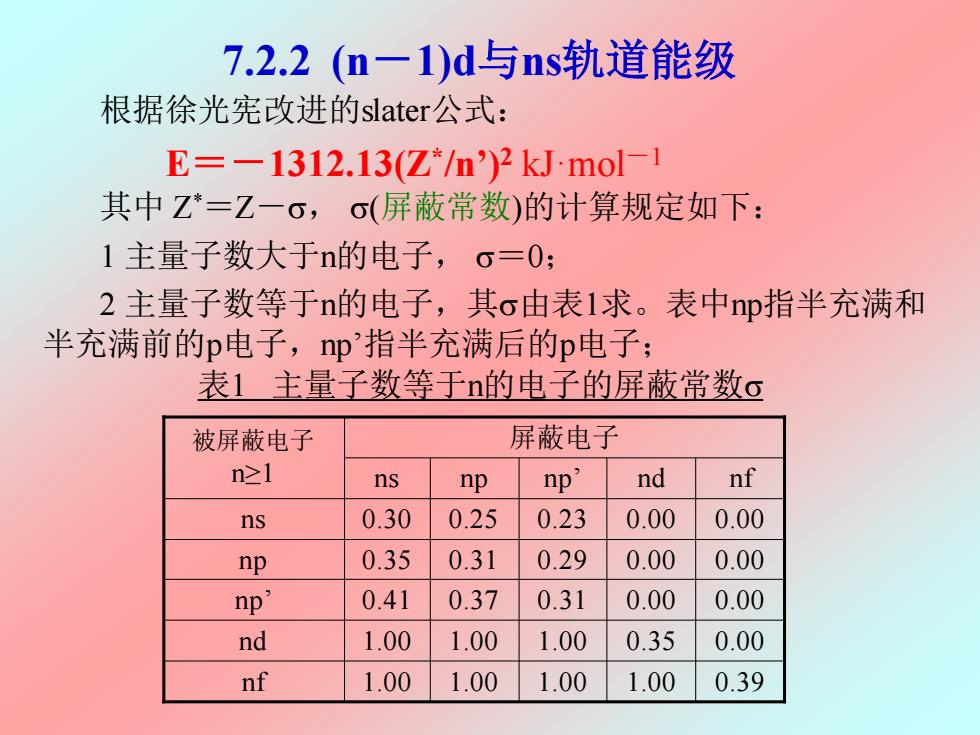
7.2.2(n-1)d与ns轨道能级 根据徐光宪改进的slater公式: E=一1312.13(Z*/n)2 kJ.mol-1 其中Z*=Z一6,σ(屏蔽常数)的计算规定如下: 1主量子数大于n的电子,o=0; 2主量子数等于n的电子,其c由表1求。表中np指半充满和 半充满前的p电子,np指半充满后的p电子; 表1主量子数等于n的电子的屏蔽常数o 被屏蔽电子 屏蔽电子 n≥1 ns np np' nd nf ns 0.30 0.25 0.23 0.00 0.00 np 0.35 0.31 0.29 0.00 0.00 np' 0.41 0.37 0.31 0.00 0.00 nd 1.00 1.00 1.00 0.35 0.00 nf 1.00 1.00 1.00 1.00 0.39
7.2.2 (n-1)d与ns轨道能级 根据徐光宪改进的slater公式: E=-1312.13(Z* /n’)2 kJ·mol-1 其中 Z * =Z-, (屏蔽常数)的计算规定如下: 1 主量子数大于n的电子, =0; 2 主量子数等于n的电子,其由表1求。表中np指半充满和 半充满前的p电子,np’指半充满后的p电子; 表1 主量子数等于n的电子的屏蔽常数 0.39 0.00 0.00 0.00 0.00 nf np’ 0.41 0.37 0.31 0.00 nf 1.00 1.00 1.00 1.00 nd 1.00 1.00 1.00 0.35 np 0.35 0.31 0.29 0.00 ns 0.30 0.25 0.23 0.00 ns np np’ nd 被屏蔽电子 屏蔽电子 n≥1