
酸碱滴定法的基本原理 ▣强酸(强碱)的滴定 ▣一元弱酸(碱)的滴定 ▣多元酸碱的滴定 ▣酸碱标准溶液的配制和标定(自学) ▣应用示例(自学)
酸碱滴定法的基本原理 强酸(强碱)的滴定 一元弱酸(碱)的滴定 多元酸碱的滴定 酸碱标准溶液的配制和标定(自学) 应用示例(自学)

▣酸碱滴定的核心问题 ()滴定曲线和化学计量点H的计算 (2)指示剂的选择 (3)正确判断被测物质能否被准确滴定
(1)滴定曲线和化学计量点pH的计算 (2)指示剂的选择 (3)正确判断被测物质能否被准确滴定 酸碱滴定的核心问题

强酸(强碱)的滴定 滴定常数K:酸碱滴定反应的平衡常数,反映 滴定反应进行的完全程度。 1.强酸(强碱)的滴定:H中+O=H,O K2可k. =1.0×104
1.强酸(强碱)的滴定: H+ + OH- = H2O 1 4 10 10 1 1 = = = + − . H OH K K w t 滴定常数Kt:酸碱滴定反应的平衡常数,反映 滴定反应进行的完全程度。 强酸(强碱)的滴定

2.强碱滴定弱酸:O+HA=A+H0 3强酸滴定弱碱: H++B HB+ HA 1K6 K.-H4]K.Ko
2.强碱滴定弱酸: OH- + HA = A- + H2O W a b t K K HA OH K A K = = = − − 1 3.强酸滴定弱碱: H+ + B = HB + K HA H A K K K t a b W = = = + − 1

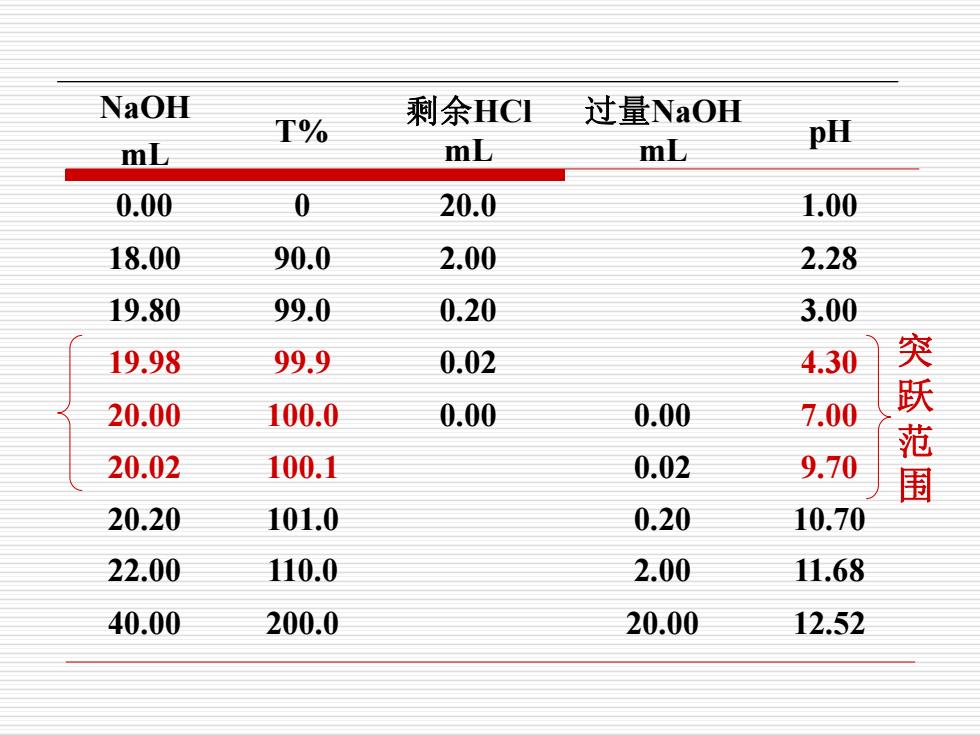
NaOH与HCI的滴定过程 设HCl的浓度c.为0.1000mol/L,体积a=20.00ml, NaOH的浓度c,为0.1000mol/① ●滴定 蘑液组成:HC 溶液的pH值等于HCI溶液的原始浓度。 H]0.1000mol/L,pH=1.00
NaOH与HCl的滴定过程 •滴定 前溶液组成: HCl 溶液的pH值等于HCl溶液的原始浓度。 [H+ ] =0.1000 mol/L ,pH=1.00 设HCl的浓度ca为0.1000mol/L,体积Va=20.00 ml, NaOH的浓度cb为0.1000mol/L

●滴定至化学计量点前('>) 溶液组成:NaC+HCI 溶液的pH值取决于剩余HCI的量和溶液的总体积。 c 当Vb=19.98ml时(SP前0.1%) ] 20.00-19.98 ×0.1000=5.00×10-5mol/L) 20.00+19.98 pH=4.30
•滴定至化学计量点前(Va > Vb) a b a b a V V V V H C + − = + 当Vb=19.98 ml时( SP前0.1% ) pH 4.30 0.1000 5.00 10 (mol/L) 20.00 19.98 20.00 19.98 H 5 = = + − = + − 溶液组成: NaCl+ HCl 溶液的pH值取决于剩余 HCl的量和溶液的总体积

·滴定至化学计量点Ⅳ=) 溶液组成:NaCl V.=V。-20.00ml H]=0H=10-7mol/L,pH=7.00
•滴定至化学计量点 (Va =Vb ) 溶液组成: NaCl Va =Vb=20.00ml [H+ ]=[OH- ]=10-7 mol/L , pH=7.00

。滴定至化学计量点后(V,<',) 溶液组成NaC土NaOH 溶液的pH值取决于过量的NaOH的量和溶液的总体积 m]cy袋 当',=20.02ml(化学计量点后0.1%) fon 20.02-20.00 ×01000=5.00x10-(mo/L 20.00+20.02 pH=9.70
•滴定至化学计量点后(Va < Vb) 溶液组成 NaCl+ NaOH 溶液的pH值取决于过量的NaOH的量和溶液的总体积 a b b a b - V V V V OH C + − = pH 9.70 0.1000 5.00 10 (mol/L) 20.00 20.02 20.02 20.00 OH 5 = = + − = − − 当Vb=20.02 ml(化学计量点后0.1%)
NaOH 剩余HCI 过量NaOH T% pH mL mL mL 0.00 0 20.0 1.00 18.00 90.0 2.00 2.28 19.80 99.0 0.20 3.00 19.98 99.9 0.02 4.30 突 20.00 100.0 0.00 0.00 7.00 范 20.02 100.1 0.02 9.70 20.20 101.0 0.20 10.70 22.00 110.0 2.00 11.68 40.00 200.0 20.00 12.52
NaOH mL T% 剩余HCl mL 过量NaOH mL pH 0.00 0 20.0 1.00 18.00 90.0 2.00 2.28 19.80 99.0 0.20 3.00 19.98 99.9 0.02 4.30 20.00 100.0 0.00 0.00 7.00 20.02 100.1 0.02 9.70 20.20 101.0 0.20 10.70 22.00 110.0 2.00 11.68 40.00 200.0 20.00 12.52 突跃范围

NaOH溶液滴定HCI溶液的滴定曲线 14 12 酚酞 10 酸碱滴定曲线: 酚酞 8 pH-V曲线 PH 计量点 pH=T%曲线 6 甲基橙 4 甲基橙 2 0 50 100 150 200(%) 10 20 30 40(ml) NaOH加入量
酸 碱 滴 定 曲 线 : pH-V 曲线 pH—T%曲线 NaOH 溶液滴定HCl溶液的滴定曲线 甲基橙 酚酞