
石河子大学化学化工学院分析化学教案 1.理解络合物平衡体系中的形成常数和离解常数,逐级形成常数和逐级离解期数,积累 形成常数和积累离解常数,总形成常数和总离解常数的意义: 触 2 掌握络合物表观稳定常数的意义及副反应对络合平衡的影响: 3 了解乙二胺四乙酸(即EDTA)滴定过程中,金属离子浓度的变化规律,掌握影响络合 滴定突跃大小的因素及络合滴定条件: 4.了解金属指示剂的作用原理。熟悉几种常用金属指示剂的性能和选用条件: 5.掌握络合滴定的有关计算方法。 教学 重点:表观稳定常数及络合滴定的有关计算。 重点 难点:配位滴定条件及副反应对络合平衡的影响。 教学 讲授为主,启发式和互动式相结合: 多媒体教学与传统教学相结合。 概述 1,络合滴定中的滴定剂:2.DTA及其二钠盐的性质:3.DTA与金属离子形成的配合物的特点. 二、溶液中各级络合物型体的分布 1.络合物的形成常数: 2.溶液中各级络合物型体的分有 学 三、络合滴定中的副反应和条件形成常数 ,副反应系数: 2.络合物的条件形成常数和绝对形成常数 四、EDTA滴定曲线 1,滴定曲线的绘制:2.形响滴定突跃的主要因素。 五、络合滴定指示剂 容 1,金属指示剂的作用原星:2.金属指示剂必具备的条件:3.金属指示剂变色点的pM值: 4.金属指示剂在使用中存在的问题:5.常用金属指示剂简介。 六、终点误差和准确滴定的条件 1.终点误差:2.直接准确滴定金属离子的条件:3.络合滴定中酸度的选择与控制。 七、提高络合滴定选择性的方法 分步前定的可行性判据:2控制酸度讲行混合离子的洗轻滴定, 3.使用掩剂提高络合滴定的选择性 :4.选用其它的滴定剂:5.化学分离法。 八、络合滴定的方式和应用 课外 学习 根据本章要求,查阅相关资料,并上课程网复习巩固,完成相应作业。 要求 教学 后记 第六章络合滴定法 3
石河子大学化学化工学院-分析化学教案 3 第六章 络合滴定法 教学 目的 要求 1. 理解络合物平衡体系中的形成常数和离解常数,逐级形成常数和逐级离解期数,积累 形成常数和积累离解常数,总形成常数和总离解常数的意义; 2. 掌握络合物表观稳定常数的意义及副反应对络合平衡的影响; 3. 了解乙二胺四乙酸(即 EDTA)滴定过程中,金属离子浓度的变化规律,掌握影响络合 滴定突跃大小的因素及络合滴定条件; 4. 了解金属指示剂的作用原理。熟悉几种常用金属指示剂的性能和选用条件; 5. 掌握络合滴定的有关计算方法。 教学 重点 难点 重点:表观稳定常数及络合滴定的有关计算。 难点:配位滴定条件及副反应对络合平衡的影响。 教学 方法 手段 讲授为主,启发式和互动式相结合; 多媒体教学与传统教学相结合。 教 学 内 容 提 纲 一、概述 1. 络合滴定中的滴定剂; 2. EDTA 及其二钠盐的性质; 3. EDTA 与金属离子形成的配合物的特点。 二、溶液中各级络合物型体的分布 1. 络合物的形成常数; 2. 溶液中各级络合物型体的分布。 三、络合滴定中的副反应和条件形成常数 1. 副反应系数; 2. 络合物的条件形成常数和绝对形成常数。 四、EDTA 滴定曲线 1. 滴定曲线的绘制; 2. 影响滴定突跃的主要因素。 五、络合滴定指示剂 1. 金属指示剂的作用原理; 2. 金属指示剂必须具备的条件; 3. 金属指示剂变色点的 pM 值; 4. 金属指示剂在使用中存在的问题; 5. 常用金属指示剂简介。 六、终点误差和准确滴定的条件 1. 终点误差; 2. 直接准确滴定金属离子的条件; 3. 络合滴定中酸度的选择与控制。 七、提高络合滴定选择性的方法 1. 分步滴定的可行性判据; 2. 控制酸度进行混合离子的选择滴定; 3. 使用掩蔽剂提高络合滴定的选择性; 4. 选用其它的滴定剂; 5. 化学分离法。 八、络合滴定的方式和应用 课外 学习 要求 根据本章要求,查阅相关资料,并上课程网复习巩固,完成相应作业。 教学 后记

石河子大学化学化工学院分析化学教案 讲程 56-1 络合滴定法概述 络合滴定法是以形成络合物的反应为基础的滴定分析方法。络合滴定的反应是金属离子和阴离子(或 分子)以配位键结合生成络离子的反应。 能用于络合滴定的反应必须具备以下几个条件: ①形成的络合物(或络离子)要相当稳定: ②在一定的反应条件下,必须生成配位数一定的络合物 ③络合反应速度要快: ④要有适当的指示剂或其它方法,简便、正确地指出反应等量点的到达。 一、络合滴定中的清定剂 无机配位反应中,除个别反应(如Ag+与CN,H2+与C1等反应)外,大多数不能用于络合滴定。 有机配位剂分子中常含有两个以上的可键合的原子,与金属离子配位时形成低配位比的具有环状结构 的整合物。有机配位反应广泛用于配位滴定分析中 广泛用作配位滴定剂的有机物质,是含有 (CH:COOH2”集团的有机化合物,称为氨羧配位剂。 其分子中含有氨氨(图1)和羧氧(图2)配位原子。 N 图1 图2 氨羧配位剂兼有氨氮与羧氧的配位能力,几乎能与所有金属离子配位 目前研究过的氨羧配位剂有几十种,其中应用最广的就是乙二胺四乙酸,简称EDTA: 用EDTA作标准溶液进行滴定的方法,称为EDTA滴定法。 二、EDTA及其二钠盐的性质 在溶液中EDTA为双偶极离子结构: Hooc-CH、 HN-CH,一CHH cH,一COoH EDTA在水溶液中,分六级离解:(见课件) -H+ -H+ -H+ 一H+ -H* H HY- 根据第5章的分布分数的计算公式,可得各型体的分 布分 如: K.KK 0、+ 以6为纵坐标,呀店男相际思5:济 TA名有在形式在不 Q)在H>12时以y+形式存在 ②)Y形式是配位的有效形式
石河子大学化学化工学院-分析化学教案 4 进程: §6-1 络合滴定法概述 络合滴定法是以形成络合物的反应为基础的滴定分析方法。络合滴定的反应是金属离子和阴离子(或 分子)以配位键结合生成络离子的反应。 能用于络合滴定的反应必须具备以下几个条件: ①形成的络合物(或络离子)要相当稳定; ②在一定的反应条件下,必须生成配位数一定的络合物; ③络合反应速度要快; ④要有适当的指示剂或其它方法,简便、正确地指出反应等量点的到达。 一、络合滴定中的滴定剂 无机配位反应中,除个别反应(如 Ag+与 CN -,Hg2+与 Cl-等反应)外,大多数不能用于络合滴定。 有机配位剂分子中常含有两个以上的可键合的原子,与金属离子配位时形成低配位比的具有环状结构 的螯合物。有机配位反应广泛用于配位滴定分析中。 广泛用作配位滴定剂的有机物质,是含有“—N(CH2COOH)2”集团的有机化合物,称为氨羧配位剂。 其分子中含有氨氮(图 1)和羧氧(图 2)配位原子。 氨羧配位剂兼有氨氮与羧氧的配位能力,几乎能与所有金属离子配位。 目前研究过的氨羧配位剂有几十种,其中应用最广的就是乙二胺四乙酸,简称 EDTA。 用 EDTA 作标准溶液进行滴定的方法,称为 EDTA 滴定法。 二、EDTA 及其二钠盐的性质 在溶液中 EDTA 为双偶极离子结构: EDTA 在水溶液中,分六级离解:(见课件) 根据第 5 章的分布分数的计算公式,可得各型体的分 布分数。 如: 以δ为纵坐标,以 pH 值为横坐标作图,可以绘出 1 1 2 EDTA 1 2 3 4 5 6 1 2 3 6 4 a a a a a a a a 4 a 6 5 a a a a Y [H ] [H ] K [H ] K K K K K K K K K K K K δ + + + = + + + −

石河子大学化学化工学院分析化学教案 溶液中各种存在形式的分布分数8与pH值的关系图(下图)。 在EDTA与金属离子形成的配合物中,以Y4与金属离子形成的配合物最为稳定。 EDTA在水中的溶解度很小,难溶于酸和有机溶剂,易溶于NOH或NH,溶液形成相应的盐。所以在 配位滴定中,通常使用的是乙二胺四乙酸的二钠盐,也简称为EDTA或EDTA的二钠盐,用NaHY·2H 来表示。EDTA二钠盐是一种白色结晶状粉末,无臭、无味、无毒、稳定,吸湖性小,易于精制,可直接 配制成标淮溶液,且易溶于HO。 三、EDTA与金属离子形成的配合物的特点 1.EDTA具有广泛的配位性能,几乎能与所有 金属离子 形成配合物,且绝大多数EDTA配合物相当稳 定。 阳干 一些金属离子与EDFTA形成的配合物的稳定 常数(见下表)。表中数据有何规律? 稳定常数具有以下规律: (1)碱金属离子的配合物最不稳定,gKMY 20 在适当条件下,只要gK®>8就可以准确测定(后面要讲), 因此,既使碱土金属也可用EDTA滴定。 注:①表中数据是指无副反应的情况下的数据,不能反映 实际滴定过程中的真实状况。 ②配合物的稳定性受两方面的影响:金属离子自身性质和 外界条件。 引入:条件稳定常数。 2.EDTA与金属离子形成配合物的配位比简单,在一般情 况下,几平均为1:1。 3.EDTA与金属离子形成的络合物大多带电荷,能溶于 H,0中, 一般络合反应迅速,使滴定能在水溶液中进行。 4.EDTA与无色金属离子形成的络合物无色,而与有色金 EDTA-Co(II藿合物的立体结构图 属离子则生成颜色更深的络合物。 6-2溶液中各级络合物型体的分布 、络合物的形成常数 (一)ML(1:1)型络合物 如果以M代表金属离子,L代表络合剂。M和L以1:1配位,则生成配位比为1:1的络合物, 为简便起见,书写时省略离子的电荷符号。 IMLI ⑧ M+L ML 平时K=K 如果考虑ML的离解,则
石河子大学化学化工学院-分析化学教案 5 溶液中各种存在形式的分布分数δ与 pH 值的关系图(下图)。 在 EDTA 与金属离子形成的配合物中,以 Y4-与金属离子形成的配合物最为稳定。 EDTA 在水中的溶解度很小,难溶于酸和有机溶剂,易溶于 NaOH 或 NH3 溶液形成相应的盐。所以在 配位滴定中,通常使用的是乙二胺四乙酸的二钠盐,也简称为 EDTA 或 EDTA 的二钠盐,用 Na2H2Y·2H2O 来表示。EDTA 二钠盐是一种白色结晶状粉末,无臭、无味、无毒、稳定,吸潮性小,易于精制,可直接 配制成标准溶液,且易溶于 H2O。 三、EDTA 与金属离子形成的配合物的特点 1. EDTA 具有广泛的配位性能,几乎能与所有 金属离子 形成配合物,且绝大多数 EDTA 配合物相当稳 定。 一些金属离子与EDFTA形成的配合物的稳定 常数(见下表)。表中数据有何规律? 稳定常数具有以下规律: (1)碱金属离子的配合物最不稳定, lg KMY <3; (2)碱土金属离子的 lgKMY = 8~11; ( 3) 过 渡 金 属 、稀 土 金 属 离 子和 Al3+ 的 lgKMY=15~19 (4)三价,四价金属离子及 Hg2+的 lgKMY>20 在适当条件下,只要lgK 稳>8就可以准确测定(后面要讲), 因此,既使碱土金属也可用 EDTA 滴定。 注:①表中数据是指无副反应的情况下的数据, 不能反映 实际滴定过程中的真实状况。 ②配合物的稳定性受两方面的影响:金属离子自身性质和 外界条件。 引入:条件稳定常数。 2. EDTA 与金属离子形成配合物的配位比简单,在一般情 况下,几乎均为 1∶1。 3. EDTA 与金属离子形成的络合物大多带电荷,能溶于 H2O 中,一般络合反应迅速,使滴定能在水溶液中进行。 4. EDTA 与无色金属离子形成的络合物无色,而与有色金 属离子则生成颜色更深的络合物。 §6-2 溶液中各级络合物型体的分布 一、络合物的形成常数 (一)ML(1∶1)型络合物 如果以 M 代表金属离子,L 代表络合剂。M 和 L 以 1∶1 配位,则生成配位比为 1∶1 的络合物。 为简便起见,书写时省略离子的电荷符号。 即 M + L ML 平衡时, 如果考虑 ML 的离解,则 [M][L] [ML] K形 = KML =

石河子大学化学化工学院分析化学教案 M≥M+L 平衡时, Kae-on 1 K6K碳 (二)Mn(1:n)型络合物 对于配位比为1:n的络合物(四师P.156),由于MLn的形成和离解都是逐级进行的,所以有逐级 (各级)形成常数(ki形)、逐级离解常数(k离解)和积累形成常数(B)、积累离解常数之分。 如:(见课件 对于1:n的配合物,同一级的K形与k离解不是倒数关系,而是第一级形成常数是第n级离解常数 的倒数,第二级形成常数是第1级离解常数的倒数。如此类推。这是逐级形成常数与逐级离解常数的关 系。 k=k 1 1 积累形成常数是各级形成常数的乘积。它与逐级形成常数、逐级离解常数之间的关系为: B,=k,-1 [ML] (第一级积累形成常数=第一级形成常数=第级离解常数的倒数) (第二级积紫形成常数=第一级和第二级形成常数的乘积-第级和第-l级离解常数的乘积的倒数) 民=kk品 最后一级积累形成常数(B)又叫总形成常数(K形),最后一级积累离解常数(Bn')又叫总离解常 数(K离解') kkk B.=kk,k.kk.k 1 Ka形=B。=k,k2k K总离期=B。=kk.k 1 K包形一K电附 二、溶液中各级络合物型体的分布 根据物料平衡: CM-[M]+[ML]+[ML:]+ +[MLa] =[M)+B[M][L]+B:[M][L]+.+B-(M][L]" =M(1+BL+BL+.BL) 根据分布分数的定义,就可得到配合物各存在形式的分布分数。 6v =[MI aBu色+AT-BiA西 IMI 1 CMM1+B,叫+B,叫+.+B.凹)1+B,叫+B,凹+.+B.叫 6n-MLl BM° B ILI" CMM(1+B,凹+B,叫2++B.山)1+B,叫+B,叫++B.山 6
石河子大学化学化工学院-分析化学教案 6 ML M + L 平衡时, (二)MLn(1∶n)型络合物 对于配位比为 1∶n 的络合物(四师 P.156),由于 MLn 的形成和离解都是逐级进行的,所以有逐级 (各级)形成常数(k i 形)、逐级离解常数(ki 离解)和积累形成常数(βi)、积累离解常数之分。 如:(见课件) 对于 1∶n 的配合物,同一级的 K 形与 k 离解不是倒数关系,而是第一级形成常数是第 n 级离解常数 的倒数,第二级形成常数是第 n-1 级离解常数的倒数。如此类推。这是逐级形成常数与逐级离解常数的关 系。 积累形成常数是各级形成常数的乘积。它与逐级形成常数、逐级离解常数之间的关系为: (第一级积累形成常数=第一级形成常数=第 n 级离解常数的倒数) (第二级积累形成常数=第一级和第二级形成常数的乘积=第 n 级和第 n-1 级离解常数的乘积的倒数) 最后一级积累形成常数(βn)又叫总形成常数(K 形),最后一级积累离解常数(βn′)又叫总离解常 数(K 离解′) 二、溶液中各级络合物型体的分布 根据物料平衡: CM=[M]+[ML]+[ML2]+.+[MLn] =[M]+β1[M][L]+β2[M][L]2+.+βn[M][L]n =[M](1+β1[L]+β2[L]2+.βn[L]n) 根据分布分数的定义,就可得到配合物各存在形式的分布分数。 [ML] [M][L] K离解 = 离解 形 K 1 K = ' n 1 k 1 k = ' n 1 2 k 1 k − = ' 1 ' n 1 ' n n 1 2 n k k k 1 β k k k − = = [M][L] [ML] β1 = k1 = 2 2 2 1 2 [M][L] [ML ] β = k k = n n n 1 2 n [M][L] [ML ] β = k k k = K βn k1 k2 kn 总形 = = K βn k1 k2 kn = = 总离解 总离解 总形 K 1 K = [M](1 β [L] β [L] β [L] ) [M] C [M] δ n n 2 M 1 2 M + + + + = = n n 2 1 2 1 β [L] β [L] β [L] 1 + + + + = [M](1 β [L] β [L] β [L] ) β [M][L] C [ML] δ n n 2 1 2 1 M ML + + + + = = n n 2 1 2 1 1 β [L] β [L] β [L] β [L] + + + + = [M](1 β [L] β [L] β [L] ) β [M][L] C [ML ] δ n n 2 1 2 n n M n MLn + + + + = = n n 2 1 2 n n 1 β [L] β [L] β [L] β [L] + + + + =

石河子大学化学化工学院分析化学教案 例:在1.0×102mol/L的铜铵溶液中,已知游离NH的浓度为1.0×10molL。计算Cu2、CuNH2 的平衡浓度。 解:查表得 B1=10315;B2=10763;B3=101053;B4=10267 1+BINH,1+B,LNH,P+B,LNH,]+B.LNH,] -1+1051.0×10-)+1071.0×10-3y+10050.0×103y+102670.0×10-)y 96.35=1.04×10 BINHP BINH,]B.LNH,F +BLNH,T+BLNH,] -105900x10-y-035 96.35 [C2*]=6aCc=1.04×102x1.0x102=1.04×10(mol1L) [CNH,g]=aum,Ca=0.35x10x10-2=3.5x10(mol/) 答:略 §6-3络合滴定中的副反应和条件形成常数 M 三MY 主反应 +H M(OH)ML MHY M(OH)Y OH +h* +OH- 副反应 M(OH)2 HY MHY M(OH)Y 水解效应 酸效 配位效应 酸式配合 共存离子效应 碱式配合物 金属离子的副反应系数 1.C 配位体的副反应系数:“司同 1
石河子大学化学化工学院-分析化学教案 7 例:在 1.0×10-2mol/L 的铜铵溶液中,已知游离 NH3 的浓度为 1.0×10-3mol/L。计算 Cu2+、Cu(NH3)3 2+ 的平衡浓度。 解:查表得 β1=104.15 ; β2=107.63 ; β3=1010.53 ; β4=1012.67 答:略 §6-3 络合滴定中的副反应和条件形成常数 4 4 3 3 3 3 2 1 3 2 3 1 [ ] [ ] [ ] [ ] 1 2 NH NH NH NH Cu + + + + + = 4.1 5 3 7.6 3 3 2 1 0.5 3 3 3 1 2.6 7 3 4 1 10 (1.0 10 ) 10 (1.0 10 ) 10 (1.0 10 ) 10 (1.0 10 ) 1 − − − − + + + + = 2 1.04 10 96.35 1 − = = 4 4 3 3 3 3 2 1 3 2 3 3 3 3 ( ) 1 [ ] [ ] [ ] [ ] [ ] 2 3 3 NH NH NH NH NH Cu NH + + + + + = 0.35 96.35 10 (1.0 10 ) 10.53 3 3 = = − [ ] 1.04 10 1.0 10 1.04 10 ( / ) 2 2 2 4 Cu 2 C 2 mol L Cu Cu + − − − = + + = = [ ( ) ] 0.35 1.0 10 3.5 10 ( / ) 2 3 ( ) 2 3 3 2 2 3 3 Cu NH C mol L Cu NH Cu + − − = + + = =

石河子大学化学化工学院分析化学教案 一、副反应系数 1,络合剂Y的副反应及副反应系数 (I)EDTA的酸效应与酸效应系数aY H EDTA在溶液中有7种存在型体 如果用CY代表未与M配位的EDTA的总浓度,则 Cy=HY+HsY+HY+H3Y+H2Y+HY+Y] 考虑酸效应的影响,Y的分布分数应为: [ 6Ho+H,]+H,+H+H,]+]+☑ KaKa.Ka 6勤H*门+[H*门K。++KaKa.K2 61+H+AH”+AHT+R,HT+A,H+H了 P.346表4不同pH值时,EDTA的酸效应系数1ga¥I 出 pH 1g0 pH 1gov() 0.0 2364 3.8 885 7.4 288 04 2132 40 844 78 247 03 1908 44 764 80 227 10 1801 48 684 84 187 14 1602 5.0 6.45 88 148 1427 54 569 90 128 20 135 58 498 93 083 24 1219 6.0 465 100 0.45 28 1100 64 406 110 007 30 1060 68 355 120 001 34 9.70 7.0 332 130 000 酸效应系数的大小说明什么问题? 配合物的稳定常数是否反映实际情况 小结:a.酸效应系数随溶液酸度增加而增大,随溶液pH增大而减小: b,aY的数值大,表示酸效应引起的副反应严重: c.通常aYH>L, [Y'J>[Y]:当aY田=1时,表示总浓度Y']=Y]: d.酸效应系数=1/分布系数 Y(H EDTA与金属离 子形成配合物的稳定常数由于酸效应的影响,不能反映不同pH条件下的实际情况 因而需要引入条件稳定常数。 求得了分布分数值,就可求得酸效应系数,从而可以判断酸度对主反应的影响程度
石河子大学化学化工学院-分析化学教案 8 一、副反应系数 1. 络合剂 Y 的副反应及副反应系数 ⑴ EDTA 的酸效应与酸效应系数αY(H) EDTA 在溶液中有 7 种存在型体。如果用 CY 代表未与 M 配位的 EDTA 的总浓度,则 CY=[H6Y]+[H5Y]+[H4Y]+[H3Y]+[H2Y]+[HY]+[Y] 考虑酸效应的影响,Y 的分布分数应为: 酸效应系数的大小说明什么问题? 配合物的稳定常数是否反映实际情况? 小结:a. 酸效应系数随溶液酸度增加而增大,随溶液 pH 增大而减小; b. αY(H)的数值大,表示酸效应引起的副反应严重; c. 通常αY(H) >1, [Y′] > [Y];当αY(H) = 1 时,表示总浓度[Y′] = [Y]; d. 酸效应系数 = 1 / 分布系数。 αY(H) = 1 /δ EDTA 与金属离子形成配合物的稳定常数由于酸效应的影响,不能反映不同 pH 条件下的实际情况, 因而需要引入条件稳定常数。 求得了分布分数值,就可求得酸效应系数,从而可以判断酸度对主反应的影响程度

石河子大学化学化工学院分析化学教案 (2②)共存离子效应 如果溶液中除了金属离子M以外,还存在着起干扰作用的金属离子N,则N也要与Y配位生成配合 物NY,使EDTA参与主反应的能力降低,这种因干扰离子而引起的副反应叫干扰离子效应或共存离子效 应。 从主反应和副反应式可看出:酸效应的影响可以降低Y参加主反应的能力,同样,干扰离子N的影 响也会降低Y参与主反应的能力。此时,假设未与M配位的Y的总浓度为C¥。则 Cy=YH+HY+IHYI+IHYI+IHYHIHsYHIH YHINYI 如果只考虑酸效应的影响,则 Cy (H)=[Y]+[HY]+[H:Y}+[HYH+[H.Y]-[HY]+H.Y] 如果只考虑干扰离子的影响,则 Cy (N)=[Y]+[NY] Cy=CY +Cy (N2-Y] 等式两端同除以Y,则 1 atay-1 1-1 上式反骏T和子因素对Y的影响。 上式中,可由下两式求得6Y(H)和6Y(N): KK.K m旧rf+旧fK++KK.K IY] Y M iwCm+yM+KnN网i+KN 如果干扰离子有多种,也可同法导出: 1 1 -++(1-p) 2.金属离子M的副反应及副反应系数 (1)M的络合效应与络合效应系数 M与Y的配位反应是主反应,如果溶液中还存在另一配位剂L,它也能与M形成逐级配合物,使主 反应受到影响。这种因辅助配位剂L而引起的副反应,叫做配位效应。 如果用C代表未被EDTA配位的M的总浓度. CN=[M]+[ML]+[ML2]+.+[MLa] =IMI+BI[MIIL1+B-IMI[L12+ +[MIILI =M(1+B+B+ +BP) CM1+,叫+B,叫+.+B.叫 1 故配位效应系粉 UL. -=1+B,叫+B,叫++B.I叫 如果辅助配位剂有多种,则可按继同法导出: 总副反应系数: OM= 11 +。1++-p)(注:p为总的影响因素的数目)
石河子大学化学化工学院-分析化学教案 9 ⑵ 共存离子效应 如果溶液中除了金属离子 M 以外,还存在着起干扰作用的金属离子 N,则 N 也要与 Y 配位生成配合 物 NY,使 EDTA 参与主反应的能力降低,这种因干扰离子而引起的副反应叫干扰离子效应或共存离子效 应。 从主反应和副反应式可看出:酸效应的影响可以降低 Y 参加主反应的能力,同样,干扰离子 N 的影 响也会降低 Y 参与主反应的能力。此时,假设未与 M 配位的 Y 的总浓度为 CY。则 CY=[Y]+[HY]+[H2Y]+[H3Y]+[H4Y]+[H5Y]+[H6Y]+[NY] 如果只考虑酸效应的影响,则 CY(H)=[Y]+[HY]+[H2Y]+[H3Y]+[H4Y]+[H5Y]+[H6Y] 如果只考虑干扰离子的影响,则 CY(N)=[Y]+[NY] ∴ CY=CY(H)+CY(N)-[Y] 等式两端同除以[Y],则 即 αY =αY(H)+αY(N)-1 或 上式反映了酸度和干扰离子两种因素对 Y 的影响。 上式中,可由下两式求得δY(H)和δY(N): 如果干扰离子有多种,也可同法导出: 2. 金属离子 M 的副反应及副反应系数 ⑴ M 的络合效应与络合效应系数 M 与 Y 的配位反应是主反应,如果溶液中还存在另一配位剂 L,它也能与 M 形成逐级配合物,使主 反应受到影响。这种因辅助配位剂 L 而引起的副反应,叫做配位效应。 如果用 CM代表未被 EDTA 配位的 M 的总浓度, ∵ CM=[M]+[ML]+[ML2]+.+[MLn] =[M]+β1[M][L]+β2[M][L]2+.+βn[M][L]n =[M](1+β1[L]+β2[L]2+.+βn[L]n ) ∴ 故 配位效应系数: 如果辅助配位剂有多种,则可按上述同法导出: 总副反应系数: (注:p 为总的影响因素的数目) 1 δ 1 δ 1 δ 1 Y Y(H) Y(N) = + − 1 1 2 6 1 2 6 a a a a 6 5 a a a Y(H) [H ] [H ] K K K K K K K δ + + + = + + 1 K [N] 1 [Y] K [N][Y] [Y] [Y] [NY] [Y] C [Y] δ Y(N) NY NY Y(N) + = + = + = = (1 p) δ 1 δ 1 δ 1 δ 1 α Y Y(H) Y(N) Y(Q) Y = = + + ++ − n n 2 M 1 2 M(L) 1 β [L] β [L] β [L] 1 C [M] δ + + + + = = n n 2 1 2 M(L) M(L) 1 β [L] β [L] β [L] δ 1 α = = + + ++ (1 p) δ 1 δ 1 δ 1 δ 1 α M M(L) M(A) M(B) M = = + + ++ −

石河子大学化学化工学院分析化学教案 (②)金属离子的水解效应和水解效应系数 金属离子M的副反应除了辅助配位剂L的影响外,还有水解效应,即OH也要与M发生副反应。 OH及L的总的影响情况可同法导出” aMom =1+B[OH-]+B2[OH-+.+B[OH-]" a1=aD+aMo-1≈au+awon 3.络合物MY的副反应及副反应系数aY 酸式络合物或碱式络合物对MY影响很小,故可不作考虑。 二、络合物的条件形成常数和绝对形成常数 对于M+Y一MY这样一个配位反应,如果溶液中没有副反应发生,则络合物的形成常数可 用下式表示: Ka-M网 IMYI ① 当有酸度、其它配位剂影响时, 6,=m - [MF6M·CM: [MYF6MY·C 将Yy、M及MY]代入①式 Kin -Kon 上式左方可以以一个新常数来表示(即用K'表示),这个新常数就叫做表观形成常数或条件形成常数 6C Kw③Cn6,-C) lgKin =lgKsn +lgos+lgoy-lgosn lgKan =lgKsn -pos -poy-lgosn 在多数情况下,配合物MY所产生的酸式配合物MHY和MOHY可以忽略(即6v=1),故上式简化为: =lgK yn-pom-poy §6-4EDTA滴定曲线 一、滴定曲线的绘制 (口金属离子不与辅助配位剂作用的情况 ,Cy mol/L的EDTA滴定CmoL的金属离子M,用去EDTA Vy ml,金属离子M的体积为 Vy mL, 属离子的浓度可计算如下: 1 滴定前 [M]-CM mol/L 2.滴定开始至计量点前
石河子大学化学化工学院-分析化学教案 10 ⑵ 金属离子的水解效应和水解效应系数 金属离子 M 的副反应除了辅助配位剂 L 的影响外,还有水解效应,即 OH-也要与 M 发生副反应。 OH -及 L 的总的影响情况可同法导出” 3. 络合物 MY 的副反应及副反应系数αMY 酸式络合物或碱式络合物对 MY 影响很小,故可不作考虑。 二、络合物的条件形成常数和绝对形成常数 对于 M + Y MY 这样一个配位反应,如果溶液中没有副反应发生,则络合物的形成常数可 用下式表示: ① 当有酸度、其它配位剂影响时, [Y]=δY·CY ; [M]=δM·CM ; [MY]=δMY·CMY 将[Y]、[M]及[MY]代入①式 上式左方可以以一个新常数来表示(即用 KMY′表示),这个新常数就叫做表观形成常数或条件形成常数 在多数情况下,配合物 MY 所产生的酸式配合物 MHY 和 M(OH)Y 可以忽略(即δMY=1),故上式简化为: §6-4 EDTA 滴定曲线 一、滴定曲线的绘制 ㈠ 金属离子不与辅助配位剂作用的情况 如果以 CY mol/L 的 EDTA 滴定 CM mol/L 的金属离子 M,用去 EDTA VY mL,金属离子 M 的体积为 VM mL,则溶液中游离金属离子的浓度可计算如下: 1. 滴定前 [M]=CM mol/L 2. 滴定开始至计量点前 n n 2 M(OH) 1 2 α 1 β [OH ] β [OH ] β [OH ] − − − = + + ++ αM = αM(L) + αM(OH) −1 αM(L) + αM(OH) [M][Y] [MY] KMY = Y Y C [Y] δ = M M C [M] δ = MY MY C [MY] δ = (δ C )(δ C ) δ C K M M Y Y MY MY MY = M Y MY MY M Y MY C C C δ δ δ K = MY M Y MY ' MY δ δ δ K K = MY M Y MY ' MY lgK = lgK + lgδ + lgδ −lgδ MY M Y MY ' MY lgK = lgK −pδ −pδ −lgδ MY M Y ' lgK MY = lgK −pδ −pδ
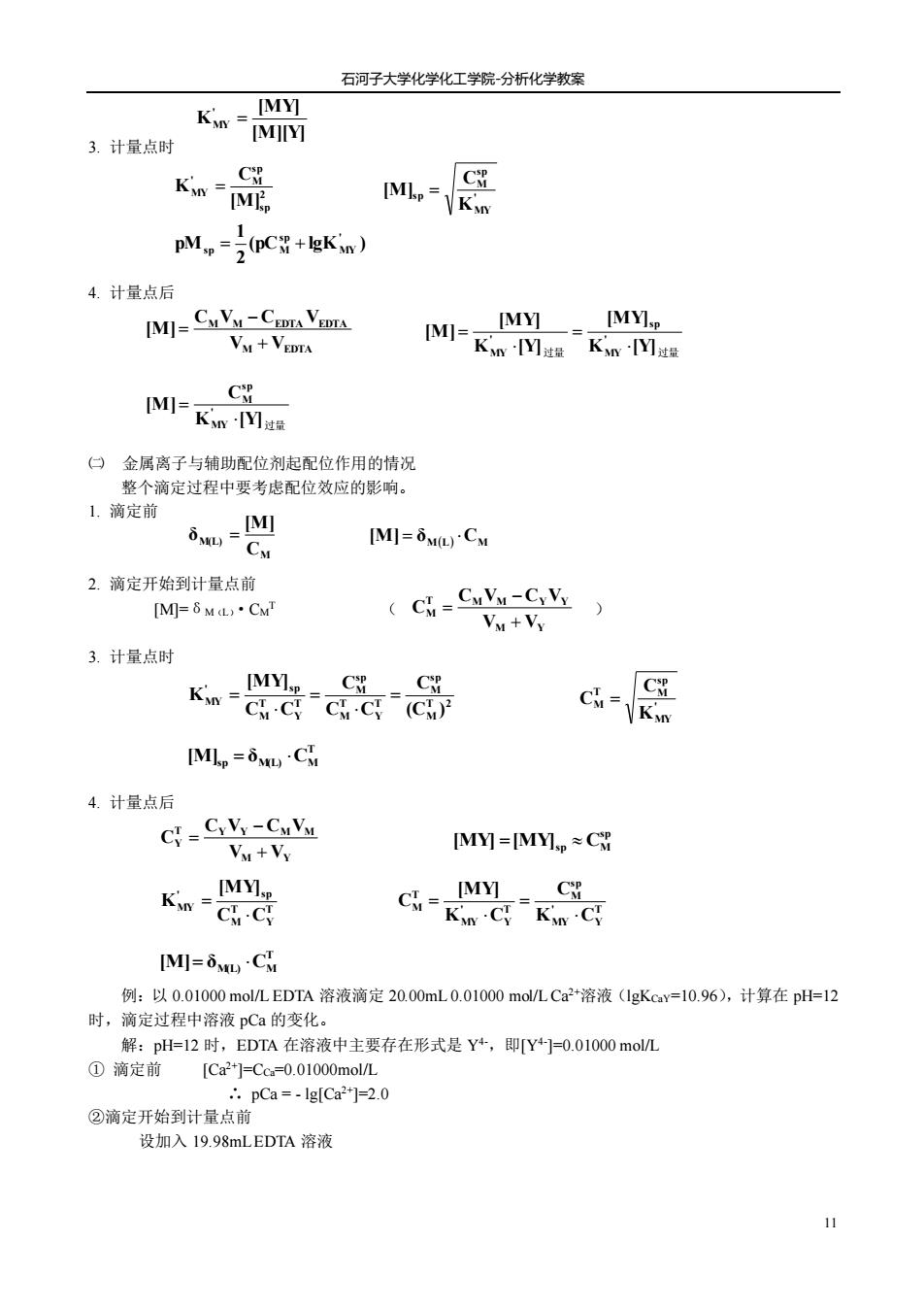
石河子大学化学化工学院分析化学教案 3.计量点时 K删 K品 C Mh-VKin pM,-nC+kn) 4.计量点后 IMI-CaVy-CmA VA IMYI [MY VM+VEDTA [MI-Kn -Kin-[Ys [MI-Kon 1V]as 口金属离子与辅助配位剂起配位作用的情况 整个滴定过程中要考虑配位效应的影响。 1.滴定前 [MI [M]=5ML).CM 2.滴定开始到计量点前 [M=6ML·C CI=CuVu-Cy Vy ) Vy+Vy 3.计量点时 Ka品 C cve [MLp =5MLC 4.计量点后 CY-CyVy-CuVu Vu+Vy IMy=MMp≈CW k器 GEK [M]=5MLCM 例:以0.01000mol/LEDTA溶液滴定20.00mL0.01000mol/LCa2*溶液(1gKcY=10.96),计算在pH=12 时,滴定过程中溶液pCa的变化。 解:pl=12时,EDTA在溶液中主要存在形式是Y+,即Y+=0.01000moL ①滴定前 [Ca2]=Cc=0.01000molL pCa =-Ig[Ca2]=2.0 ②滴定开始到计量点前 设加入19.98 mLEDTA溶液
石河子大学化学化工学院-分析化学教案 11 3. 计量点时 4. 计量点后 ㈡ 金属离子与辅助配位剂起配位作用的情况 整个滴定过程中要考虑配位效应的影响。 1. 滴定前 2. 滴定开始到计量点前 [M]=δM(L)·CM T ( ) 3. 计量点时 4. 计量点后 例:以 0.01000 mol/L EDTA 溶液滴定 20.00mL 0.01000 mol/L Ca2+溶液(lgKCaY=10.96),计算在 pH=12 时,滴定过程中溶液 pCa 的变化。 解:pH=12 时,EDTA 在溶液中主要存在形式是 Y4-,即[Y4- ]=0.01000 mol/L ① 滴定前 [Ca2+]=CCa=0.01000mol/L ∴ pCa = - lg[Ca2+]=2.0 ②滴定开始到计量点前 设加入 19.98mL EDTA 溶液 M EDTA M M EDTA EDTA V V C V C V [M] + − = 2 sp sp ' M MY [M] C K = ' MY sp M sp K C [M] = (pC lgK ) 2 1 pM ' MY sp sp = M + [M][Y] [MY] K ' MY = 过量 K [Y]过量 [MY] K [Y] [MY] [M] ' MY sp ' MY = = K [Y]过量 C [M] ' MY sp M = M M(L) C [M] δ = [M] = δM(L) CM M Y T M M Y Y M V V C V C V C + − = T 2 M sp M T Y T M sp M T Y T M ' sp MY (C ) C C C C C C [MY] K = = = ' MY sp T M M K C C = T [M]sp = δM(L) CM M Y T Y Y M M Y V V C V C V C + − = sp [MY] =[MY]sp CM T Y T M ' sp MY C C [MY] K = T Y ' MY sp M T Y ' MY T M K C C K C [MY] C = = T [M]= δM(L) CM
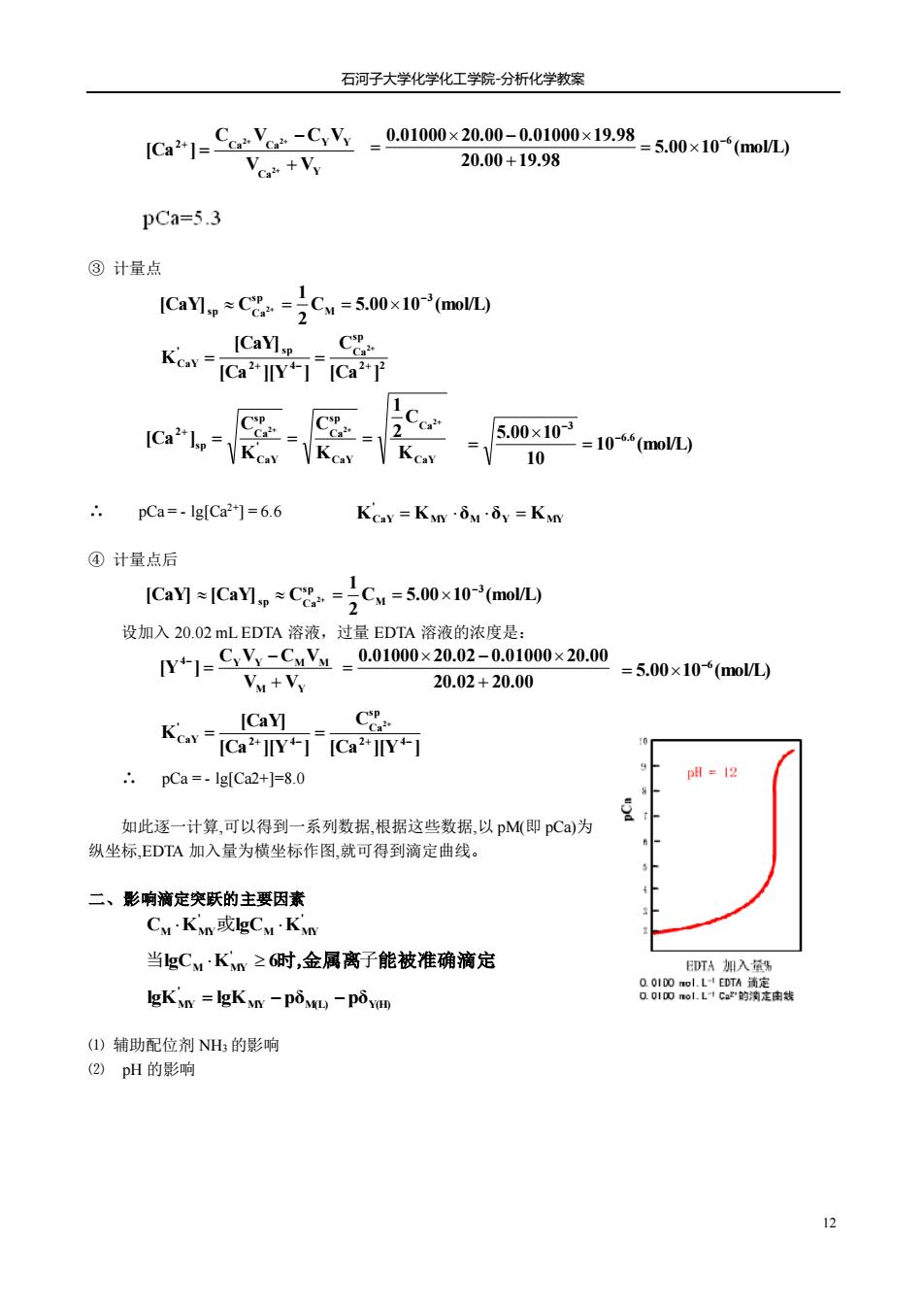
石河子大学化学化工学院分析化学教案 1Ca21=Cayr-CY-00100×2000-0n100x1998-50×10+mon Vo +Vy 20.00+19.98 pCa=5.3 ③计量点 1CaMp*C8=)C4=5.00x10-(mo ICaY] Key-ICaCa ICa"I= =500x10=10*“l 10 pCa=-Ig[Ca2*]=6.6 Kcay=Kn·iui=Kn ④计量点后 ICay]ICaYlC=Cw=5.00x10(moVL) 设加入20.02 mLEDTA溶液,过量EDTA溶液的浓度是: Y+1=CY-CX-0.01000x20.02-0.01000×20.00 Vu+Vy 20.02+20.00 =5.00×10(mol) ICaY] CP Kcav-ICa"T1[Ca2"Y可 .pCa=-Ig[Ca2+]=8.0 如此逐一计算,可以得到一系列数据,根据这些数据,以pM即pCa)为 纵坐标,EDTA加入量为横坐标作图,就可得到滴定曲线。 二、影响滴定突跃的主要因素 CuKn或gCMKy 当gC4·K≥6时,金属离子能被准确滴定 D所A期入男 lgKn=gK-pim-pi画 881四olD满赛唐 ()辅助配位剂NH的影响 (2)pH的影响
石河子大学化学化工学院-分析化学教案 12 ③ 计量点 ∴ pCa = - lg[Ca2+] = 6.6 ④ 计量点后 设加入 20.02 mL EDTA 溶液,过量 EDTA 溶液的浓度是: ∴ pCa = - lg[Ca2+]=8.0 如此逐一计算,可以得到一系列数据,根据这些数据,以 pM(即 pCa)为 纵坐标,EDTA 加入量为横坐标作图,就可得到滴定曲线。 二、影响滴定突跃的主要因素 ⑴ 辅助配位剂 NH3 的影响 ⑵ pH 的影响 Ca Y 2 Ca Ca Y Y V V C V C V [Ca ] 2 2 2 + − = + + + + 5.00 10 (mol/L) 20.00 19.98 0.01000 20.00 0.01000 19.98 −6 = + − = C 5.00 10 (mol/L) 2 1 [CaY] C 3 M sp sp Ca2 − + = = 2 2 sp Ca 2 4 ' sp CaY [Ca ] C [Ca ][Y ] [CaY] K 2 + − + + = = CaY Ca CaY sp Ca ' CaY sp Ca sp 2 K C 2 1 K C K C [Ca ] 2 2 2 + + + = = = + 10 (mol/L) 10 5.00 10 6.6 3 − − = = MY M Y MY ' KCaY = K δ δ = K C 5.00 10 (mol/L) 2 1 [CaY] [CaY] C 3 M s p s p Ca2 − + = = M Y 4 Y Y M M V V C V C V [Y ] + − = − 20.02 20.00 0.01000 20.02 0.01000 20.00 + − = 5.00 10 (mol/L) −6 = [Ca ][Y ] C [Ca ][Y ] [CaY] K 2 4 sp Ca 2 4 ' CaY 2 + − + − + = = ' M MY ' CM KMY或lgC K lgC K 6 . ' 当 M MY 时,金属离子能被准确滴定 MY M(L) Y(H) ' lgKMY = lgK −pδ −pδ