
第六章 分析化学中常用的分离方法 §6-1概述 干扰组分指样品中原有杂质(溶解)或加入试剂 引入的杂质,当杂质量少时可加掩蔽剂消除干扰,量 大或无合适掩蔽剂时可采用分离的方法。 分离完全的含义 (1)干扰组分小到不千扰 (2)被测组分损失可忽略不计。 完全与否用回收率表示 回收率三 分离后测得的量 ×100% 原始含量
干扰组分指样品中原有杂质(溶解)或加入试剂 引入的杂质,当杂质量少时可加掩蔽剂消除干扰,量 大或无合适掩蔽剂时可采用分离的方法。 第六章 分析化学中常用的分离方法 分离完全的含义 ( 1)干扰组分小到不干扰 ( 2)被测组分损失可忽略不计。 §6-1 概 述 完全与否用回收率表示 回收率= 原始含量 分离后测得的量 ×100%
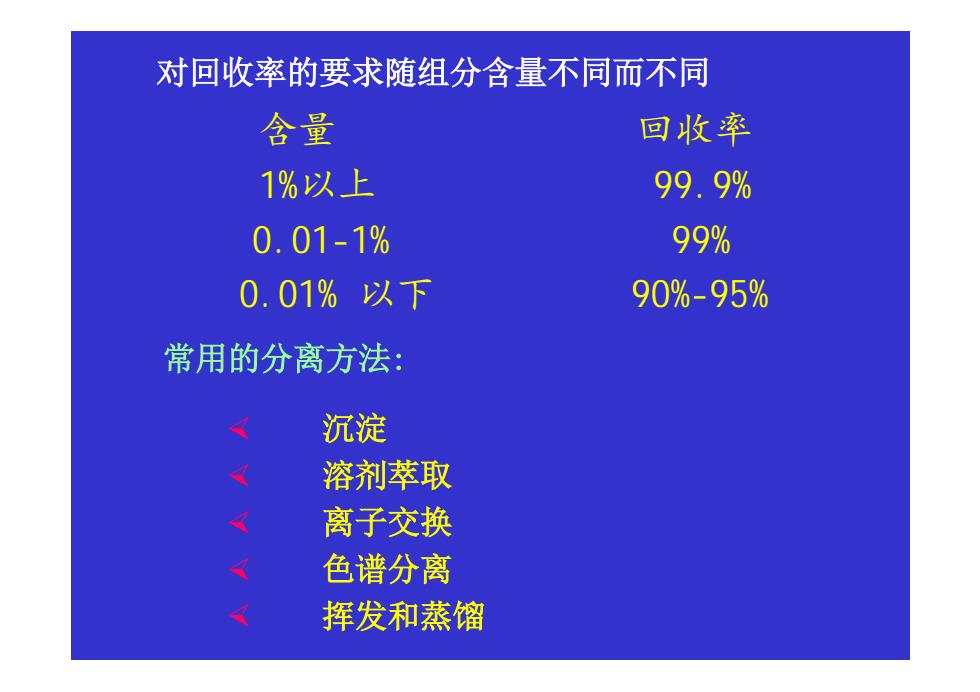
对回收率的要求随组分含量不同而不同 含量 回收率 1%以上 99.9% 0.01-1% 99% 0.01%以下 90%-95% 常用的分离方法: 沉淀 溶剂萃取 离子交换 色谱分离 挥发和蒸馏
对回收率的要求随组分含量不同而不同 含量 回收率 1%以上 99.9% 0.01-1% 99% 0.01% 以下 90%-95% ½ 沉淀 ½ 溶剂萃取 ½ 离子交换 ½ 色谱分离 ½ 挥发和蒸馏 常用的分离方法:

§6-2沉淀分离法 一.常量组分的分离 1,利用生成氢氧化物 (1)Na0H法: 以NaOH做沉淀剂,将两性与非两性氢氧化物分开 ,非两性氢氧化物沉淀下来,两性的留于溶液中。 Pb2+,A13+,Zn2*,Cr3+不沉淀(以含氧酸根形式 存在),其它的沉淀。 Na0H含C02-3,使部分Ca2t,r2+,Ba2+碳酸盐 沉淀
§6-2 沉淀分离法 一 . 常量组分的分离 (1) NaOH 法: 以 NaOH 做沉淀剂,将两性与非两性氢氧化物分开 ,非两性氢氧化物沉淀下来,两性的留于溶液中。 1. 利用生成氢氧化物 Pb2+,Al3+,Zn2+,Cr3+不沉淀(以含氧酸根形式 存在),其它的沉淀。 NaOH 含CO2-3,使部分Ca2+,Sr2+,Ba2+ 碳酸盐 沉淀

(2)NH法:(NH4存在) 以H做沉淀剂,利用生成氨络合物与氢氧化物沉淀分离, 使高价离子与一、二价离子分离。 Ag,Cd,Cu,Co2,Zn,Ni生成络合 物 Mg,Ca,Sr,Ba成离子状态,Mn会有部分沉淀。 加H的作用: ◇控制溶液的pH8-9,防止Mg(OH)2沉淀生成。 ◇N作抗衡离子,减小氢氧化物对其它金属离子的吸附。 ◆电解质促进胶状沉淀的凝聚
(2) NH3法:(NH+4存在) 以 NH3做沉淀剂,利用生成氨络合物与氢氧化物沉淀分离, 使高价离子与一、二价离子分离。 Ag+,Cd2+,Cu2+,Co2+,Zn2+,Ni2+ 生成络合物, Mg2+,Ca2+,Sr2+,Ba2+成离子状态,Mn2+会有部分沉淀。 加 NH+4的作用: 控制溶液的 pH 8-9,防止 Mg(OH)2沉淀生成。 NH+4作抗衡离子,减小氢氧化物对其它金属离子的吸附。 电解质促进胶状沉淀的凝聚。 ���

(3)有机碱法 六次甲基四胺加到酸性溶液中pH:5-6。 (4)Zn0悬浮液法 Zn0加到酸性溶液中,Zn0逐渐溶解使溶液 pH值提高,可用此法控制pH=6
(3)有机碱法 ZnO 加到酸性溶液中,ZnO 逐渐溶解使溶液 pH 值提高,可用此法控制 pH = 6。 六次甲基四胺加到酸性溶液中 pH:5-6。 (4)ZnO悬浮液法

2、疏化物沉淀 控制H可使某些硫化物沉淀,因各硫化物的 K,s不同。 s],k& a于 HS饱和时[HS]=0.1mol/L [S2-]只与[H]有关 当H]=0.3mol/L 通H2S 第二组阳离子 Pb2+ Bi3+,Cu2+,Cd2+,Hg2+,Sn2+,Sb2+,As2+沉淀 当pH=8-9NH3-NHt4通H,SFe3+,AI3+,Cr3+,Fe2+ Mn2+,Zn2+,Co2+,Ni2+沉淀
2、硫化物沉淀 H2 S饱和时 [ H2 S ]=0.1mol/L [ ] [ ] [ ]2 2 2 a a H H S S 1 2 + − = K K [ ] [ ]2 2 H 1 S + − ∝ 控制pH可使某些硫化物沉淀,因各硫化物的 Ksp,MS 不同。 [ S2- ]只与 [ H+ ]有关 当 [ H+ ]=0.3mol/L 通 H2 S , 第二组阳离子 Pb2+, Bi3+,Cu2+, Cd2+, Hg2+, Sn2+, Sb2+, As2+ 沉淀 当pH=8-9 NH3- NH+4 通 H2S Fe3+, Al3+, Cr3+, Fe2+, Mn2+, Zn2+, Co2+, Ni2+ 沉淀

3、有机沉淀剂 (1)8-羟基喹啉(C,H,ON) 8-羟基喹啉是具有弱酸弱碱性的两性试剂, 除碱金属外,其他的金属离子几乎都能与8-羟基 喹啉定量生成沉淀。各种金属离子生成沉淀的州 各不相同,因此控制酸度可使部分金属离子沉淀 ,另一部分金属离子不生成沉淀,从而达到分离 的目的。 例如在pH=5.0的HAc-Ac溶液中,A13+、Fe3+等能定 量沉淀,而Be2+、Mg2*、Ca2+、Sr2+、Ba2+等留于 溶液中
3、有机沉淀剂 (1)8-羟基喹啉(C9H7ON) 8-羟基喹啉是具有弱酸弱碱性的两性试剂, 除碱金属外,其他的金属离子几乎都能与8-羟基 喹啉定量生成沉淀。各种金属离子生成沉淀的pH 各不相同,因此控制酸度可使部分金属离子沉淀 ,另一部分金属离子不生成沉淀,从而达到分离 的目的。 例如 在pH=5.0 的HAc-Ac-溶液中,Al3+、Fe3+等能定 量沉淀,而Be2+、Mg2+、Ca2+、Sr2+、Ba2+等留于 溶液中

(2)铜铁试剂 在强酸介质中,Fe3+、Ti4针、Zr4+、 V(W)、Sn+、Cu2+、Ce4+、Nb(V)、Ta(V)等能 与此试剂定量析出沉淀。 在弱酸介质中,除上述离子外,A13+ Zn2+、Co2+、Mn2+、Th+、Be2+、Ga3+、In3+、 T13+也能与此试剂定量析出沉淀
(2)铜铁试剂 在强酸介质中,Fe3+ 、 Ti4+ 、 Zr4+ 、 V(V)、Sn4+、Cu2+、Ce4+、Nb(V)、Ta(V)等能 与此试剂定量析出沉淀。 在弱酸介质中,除上述离子外,Al3+ 、 Zn2+、Co2+、Mn2+、Th4+、Be2+、Ga3+、In3+、 Tl3+也能与此试剂定量析出沉淀

二、痕量组分的分离和富集 1、无机共沉淀分离和富集 (1)利用表面吸附进行共沉淀 uS沉淀可将0.02μgHg+从1L溶液 中沉淀出 (2)利用生成混晶 载体BaS0将少量Pb2+沉淀下来,生成 BaS04-PbS04混晶
二、痕量组分的分离和富集 1、无机共沉淀分离和富集 ( 1 )利用表面吸附进行共沉淀 CuS沉淀可将0.02µg Hg2+ 从1L 溶液 中沉淀出 ( 2)利用生成混晶 载体BaSO4将少量Pb2+沉淀下来,生成 BaSO4-PbSO4 混晶

2、有机共沉淀剂 在灼烧时沉淀剂易除去,吸附作用小,选择性 高,M大,体积大,分离效果好。 (1)利用胶体的凝聚作用进行共沉淀: 辛可宁 丹宁、动物胶 (2)利用形成离子缔合物:甲基紫、孔雀绿、晶 品红、次甲基兰。分子量大,在酸性中带 正电荷,生成难溶的缔合物。 (3)利用“固体萃取剂” 微量N不能用丁二酮肟沉淀,可用丁二酮肟二烷 酯,不溶于水,在水中析出,将微量N2+带下来
2、有机共沉淀剂 在灼烧时沉淀剂易除去,吸附作用小,选择性 高,Mr大,体积大,分离效果好。 (1)利用胶体的凝聚作用进行共沉淀: 辛可宁、 丹宁、动物胶 (2)利用形成离子缔合物:甲基紫、孔雀绿、晶 品红、次甲基兰。 分子量大,在酸性中带 正电荷,生成难溶的缔合物。 (3)利用“固体萃取剂” 微量Ni不能用丁二酮肟沉淀,可用丁二酮肟二烷 酯,不溶于水,在水中析出,将微量Ni2+带下来