正在加载图片...
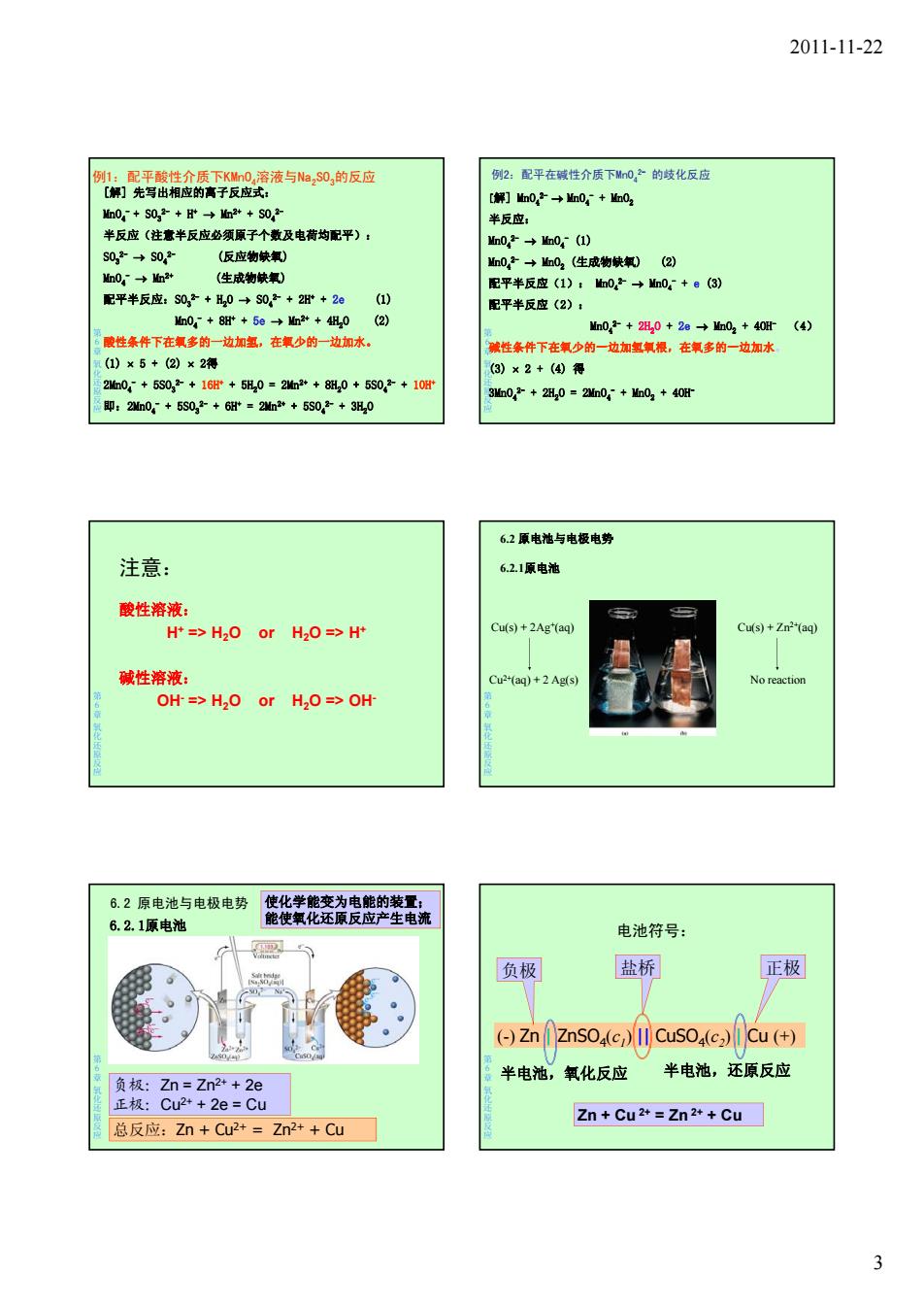
2011-11-22 例1:配平酸性介质下KMn0,溶液与NaS0,的反应 例2:配平在碱性介质下M0,的歧化反应 [解]先写出相应的高子反应式: [解]hn02→mn0,+血02 Mn0-+S0,2+→2++S02 半反应: 半反应(注意半反应必须原子个数及电荷均配平): Mn02→Mn0,(1) S0,2→$0,2 (反应物缺氧) Mn02→n02(生成物缺氧)(2) Mn0,→m2+ (生成物缺氧) 配平半反应(1):02→n0,+e(3) 配平半反应:S0,+H0→S03+2B+2e (1) 配平半反应(2): n0,+8阳+5e→Mn2++4组,0(2) Mn0,2+2L20+2e→Mn02+40f(4) 6酸性条件下在氧多的一边加氢,在氧少的一边加水。 碱性条件下在氧少的一边加氢氧根,在氧多的一边加水 (1)×5+(2)×2得 (3)×2+(4)得 2m0,+5S0g2+16f+5R,0=2m2++8H,0+5S03+10H 3n02+2H,0=2h0+Mn02+40H 即:2n0,+5S0,2+6=2n2*+5S0,2+3犯,0 6.2原电池与电极电势 注意: 6.2.1原电池 酸性溶液: H+=>H2O or H2O=>H+ Cu(s)+2Ag*(aq) Cu(s)+Zn2*(aq) 碱性溶液: Cu2+(aq)+2 Ag(s) No reaction OH-=>H2O or H2O=>OH 6.2原电池与电极电势 使化学能变为电能的装置: 6.2.1原电池 能使氧化还原反应产生电流 电池符号: 负极 盐桥 正极 (Zn ZnSo(c)Il Cuso(CCu (+ 半电池,氧化反应 半电池,还原反应 负极:Zn=Zn2*+2e 正极:Cu2*+2e=Cu Zn+Cu2+=Zn2++Cu 总反应:Zn+Cu2+=Zn2++Cu 32011-11-22 3 例1:配平酸性介质下KMnO4溶液与Na2SO3的反应 [解] 先写出相应的离子反应式: MnO4 - + SO3 2- + H+ Mn2+ + SO4 2- 半反应(注意半反应必须原子个数及电荷均配平): SO3 2- SO4 2- (反应物缺氧) MnO4 - Mn2+ (生成物缺氧) 第 6章氧化还原反应 配平半反应:SO3 2- + H2O SO4 2- + 2H+ + 2e (1) MnO4 - + 8H+ + 5e Mn2+ + 4H2O (2) 酸性条件下在氧多的一边加氢,在氧少的一边加水。 (1) 5 + (2) 2得 2MnO4 - + 5SO3 2- + 16H+ + 5H2O = 2Mn2+ + 8H2O + 5SO4 2- + 10H+ 即:2MnO4 - + 5SO3 2- + 6H+ = 2Mn2+ + 5SO4 2- + 3H2O 例2:配平在碱性介质下MnO4 2- 的歧化反应 [解] MnO4 2- MnO4 - + MnO2 半反应: MnO4 2- MnO4 - (1) MnO4 2- MnO2 (生成物缺氧) (2) 配平半反应(1): MnO4 2- MnO4 - + e (3) 第 6章氧化还原反应 配平半反应(2): MnO4 2- + 2H2O + 2e MnO2 + 4OH- (4) 碱性条件下在氧少的一边加氢氧根,在氧多的一边加水。 (3) 2 + (4) 得 3MnO4 2- + 2H2O = 2MnO4 - + MnO2 + 4OH- 注意: 酸性溶液: H+ => H2O or H2O => H+ 第 6章氧化还原反应 碱性溶液: OH- => H2O or H2O => OH- 6.2 原电池与电极电势 6.2.1原电池 Cu(s) + 2Ag+(aq) Cu(s) + Zn2+(aq) 第 6章氧化还原反应 Cu2+(aq) + 2 Ag(s) No reaction 6.2 原电池与电极电势 使化学能变为电能的装置; 能使氧化还原反应产生电流 6.2.1原电池 第 6章氧化还原反应 负极:Zn = Zn2+ + 2e 正极:Cu2+ + 2e = Cu 总反应:Zn + Cu2+ = Zn2+ + Cu 电池符号: 负极 盐桥 正极 第 6章氧化还原反应 (-) Zn | ZnSO4(c1) || CuSO4(c2) | Cu (+) Zn + Cu 2+ = Zn 2+ + Cu 半电池,氧化反应 半电池,还原反应