正在加载图片...
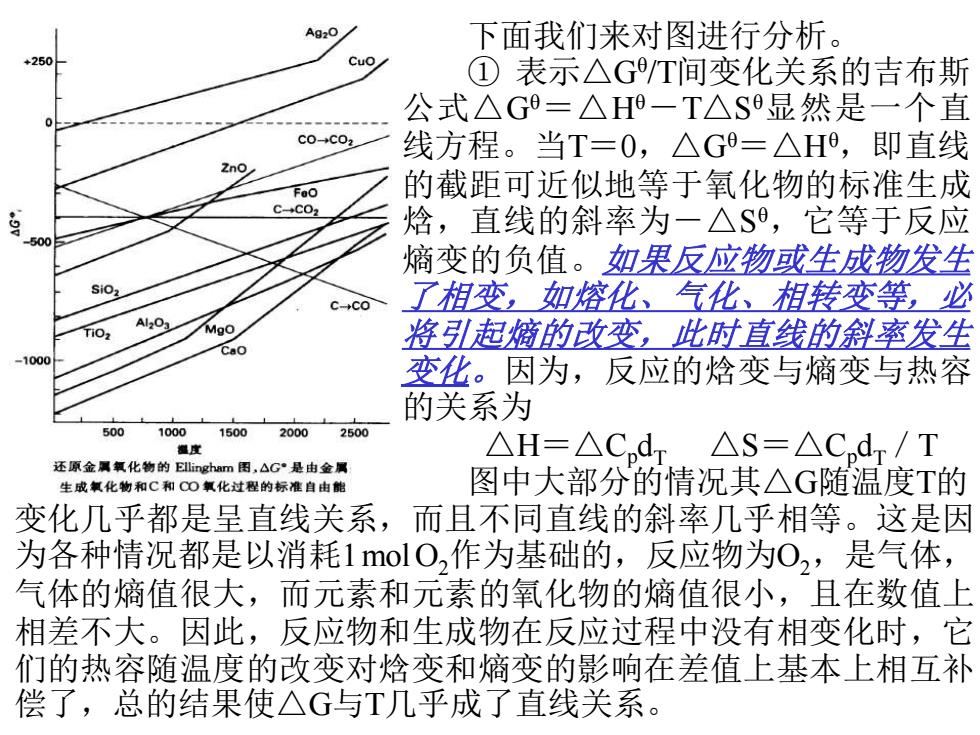
Ag2O 下面我们来对图进行分析。 Cuo ①表示△GT间变化关系的吉布斯 公式△G=△H一T△S显然是一个直 c0C02 线方程。当T=0,△G=△H,即直线 的截距可近似地等于氧化物的标准生成 C-CO2 焓,直线的斜率为一△$,它等于反应 500 熵变的负值。如果反应物或生成物发生 SiO2 C→C0 了相变,如熔化、气化、相转变等,必 A1203 Mgo 将引起熵的改变,此时直线的斜率发生 Cao -1000 变化。因为,反应的焓变与熵变与热容 的关系为 500 1000 1500 2000 2500 想度 △H=△Cd△S=△C,dr/T 还原金属氧化物的Ellingham图,△G~是由金属 生成氧化物和C和CO氧化过程的标准自由能 图中大部分的情况其△G随温度T的 变化几乎都是呈直线关系,而且不同直线的斜率几乎相等。这是因 为各种情况都是以消耗1olO,作为基础的,反应物为0,是气体, 气体的熵值很大,而元素和元素的氧化物的熵值很小,且在数值上 相差不大。因此,反应物和生成物在反应过程中没有相变化时,它 们的热容随温度的改变对焓变和熵变的影响在差值上基本上相互补 偿了,总的结果使△G与T几乎成了直线关系。 下面我们来对图进行分析。 ① 表示△Gθ /T间变化关系的吉布斯 公式△Gθ=△Hθ-T△S θ显然是一个直 线方程。当T=0,△Gθ=△Hθ ,即直线 的截距可近似地等于氧化物的标准生成 焓,直线的斜率为-△S θ ,它等于反应 熵变的负值。如果反应物或生成物发生 了相变,如熔化、气化、相转变等,必 将引起熵的改变,此时直线的斜率发生 变化。因为,反应的焓变与熵变与热容 的关系为 △H=△CpdT △S=△CpdT/T 图中大部分的情况其△G随温度T的 变化几乎都是呈直线关系,而且不同直线的斜率几乎相等。这是因 为各种情况都是以消耗1molO2作为基础的,反应物为O2,是气体, 气体的熵值很大,而元素和元素的氧化物的熵值很小,且在数值上 相差不大。因此,反应物和生成物在反应过程中没有相变化时,它 们的热容随温度的改变对焓变和熵变的影响在差值上基本上相互补 偿了,总的结果使△G与T几乎成了直线关系