正在加载图片...
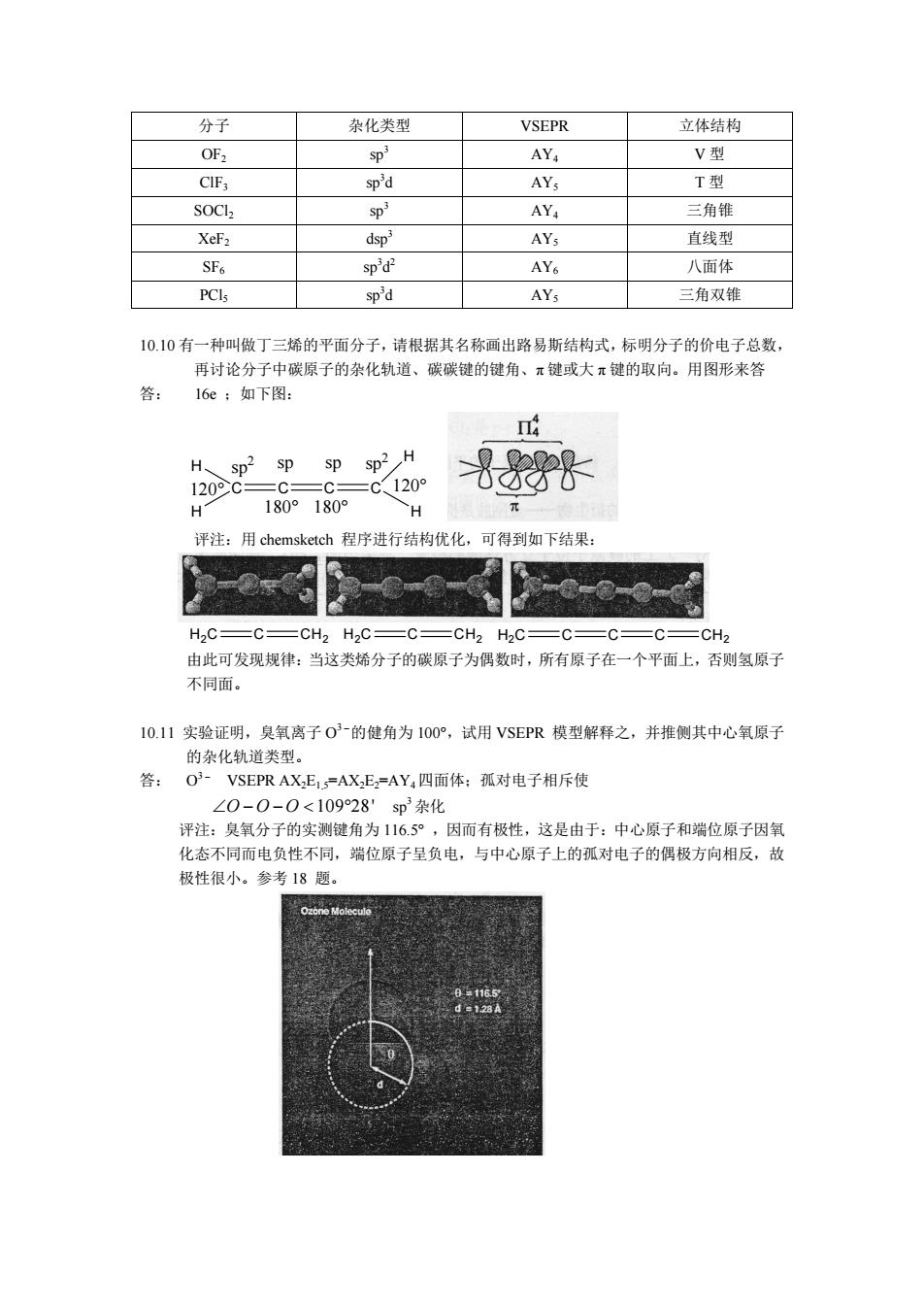
分子 杂化类型 VSEPR 立体结构 OF SD* AY V型 sp'd AYs T型 SOCL SD' AY 三角锥 dsp AY, 直线型 SF6 sp'd- AY 八面体 PCls sp'd AYs 三角双锥 10.10有一种叫做丁三烯的平面分子,请根据其名称画出路易斯结构式,标明分子的价电子总数, 再讨论分子中碳原子的杂化轨道、碳碳键的健角、π键或大π键的取向。用图形来答 答: 16e 如下图: H sp2 spsp sp2 H 120°C=C =C120 H 180°180 H 评注:用chemsketch程序进行结构优化,可得到如下结果: H,C=C=CH2 H2C=C=CH2 H2C=C=C= CH 由此可发现规律:当这类烯分子的碳原子为偶数时,所有原子在一个平面上,否则氢原子 不同面 10.11实验证明,臭氧离子03的健角为100°,试用VSEPR模型解释之,并推侧其中心氧原子 的杂化轨道类型。 答:O3-VSEPR AX.E=AXE=AY,四面体:孤对电子相斥使 ∠0-0-0<10928sp3杂化 评注:臭氧分子的实测键角为116.5°,因而有极性,这是由于:中心原子和端位原子因氧 化态不同而电负性不同,端位原子呈负电,与中心原子上的孤对电子的偶极方向相反,故 极性很小。参考18题。分子 杂化类型 VSEPR 立体结构 OF2 sp 3 AY4 V 型 ClF3 sp 3d AY5 T 型 SOCl2 sp 3 AY4 三角锥 XeF2 dsp 3 AY5 直线型 SF6 sp 3d 2 AY6 八面体 PCl5 sp 3d AY5 三角双锥 10.10 有一种叫做丁三烯的平面分子, 请根据其名称画出路易斯结构式, 标明分子的价电子总数, 再讨论分子中碳原子的杂化轨道、碳碳键的键角、π 键或大 π 键的取向。用图形来答 答: 16e ;如下图: C C C C H H H H 120° 120° 180° 180° sp2 sp sp sp 2 评注:用 chemsketch 程序进行结构优化,可得到如下结果: H 2 C C CH 2 H 2 C C CH 2 C C C CH H 2 C 2 由此可发现规律:当这类烯分子的碳原子为偶数时,所有原子在一个平面上,否则氢原子 不同面。 10.11 实验证明,臭氧离子 O 3- 的健角为 100°,试用 VSEPR 模型解释之,并推侧其中心氧原子 的杂化轨道类型。 答: O 3- VSEPR AX2E1.5=AX2E2=AY4四面体;孤对电子相斥使 –O - O - O < 109°28' sp 3 杂化 评注:臭氧分子的实测键角为 116.5° ,因而有极性,这是由于:中心原子和端位原子因氧 化态不同而电负性不同,端位原子呈负电,与中心原子上的孤对电子的偶极方向相反,故 极性很小。参考 18 题