
第10章分子结构 g:0-0:H-8-8H=0: ò=C=0: 12e 14e c 26e 34e 评注:各种教科书对路易斯结构式的定义不尽相同。涉及:(1)路易斯结构式是否一定要给 出分子的立体结构?可以不涉及,能表达更好。(2)路易斯结构式是否给出分子的全部电 子?在右机化学中常不给出,但对初学者以给出为好。3)路易斯结物式表达O,的结物时 要不要给出三电子键?不必。氧分子的三电子键属于分子轨道的理论表达,路易斯结构式 一般不涉及分子轨道理论。(4)一氧化碳的路易斯结构式要不要给出配价健?最好给。因此 上面的C0结构式最好写成: :C0: 102画出硫酸根各共振体的结构式。 :6 :6 6: 0: 0 -0:9 -0:0 . 9 0 评注:S0离子有32个价电子,即16对电子,因此,只要给出16对电子,而且氧原子 周围的电子数不超过8的路易斯结构式 可以认为是硫酸根的共振结构式。上列任 一扫 结构式并不能正确给出硫酸根的真实结构。在有的教科书中用如下之一表达硫酸根的结构 式:
第10章 分子结构 10.1 画出 O2、H2O2、CO、CO2、NCl3、SF4的路易斯结构式。不要忘记标出孤对电子和分子的 总电子数! 解: O=O H O O H C O O C O 12e 14e 10e 16e Cl N Cl Cl F S F F F 26e 34e 评注:各种教科书对路易斯结构式的定义不尽相同。涉及:( l )路易斯结构式是否一定要给 出分子的立体结构?可以不涉及。能表达更好。 (2 ) 路易斯结构式是否给出分子的全部电 子?在有机化学中常不给出,但对初学者以给出为好。(3) 路易斯结构式表达 O2的结构时 要不要给出三电子键?不必。氧分子的三电子键属于分子轨道的理论表达,路易斯结构式 一般不涉及分子轨道理论。(4 ) 一氧化碳的路易斯结构式要不要给出配价键?最好给。因此 上面的 CO 结构式最好写成: C O 10.2 画出硫酸根各共振体的结构式。 S O O O O S O O O O S O O O O S O O O O S O O O O S O O O O S O O O O S O O O O S O O O O 评注:SO4 2- 离子有 32 个价电子,即 16 对电子,因此,只要给出 16 对电子,而且氧原子 周围的电子数不超过 8 的路易斯结构式都可以认为是硫酸根的共振结构式。上列任一共振 结构式并不能正确给出硫酸根的真实结构。在有的教科书中用如下之一表达硫酸根的结构 式:
一 也有的教科书将所有硫和氧原子之间的被都画成S指向氧原子的箭头。应当注意到的事实 是,使酸根中硫原子和氧原子之间的化学键明显具有双键的性质,用单键表达,是明显馆 离事实的。从形式电荷的角度,上面的两根双键的路易斯结构式的硫原子和两个氧原子都 是零,另外两个氧原子因获得外加的电子而呈-1,是最合理的而四根单键的结构式。形 式电荷为S+2,O一1,也是可以成立的。这是路易斯结构式不能克服的内在矛盾。 10.3键可由s一s、s一p和p一p原子轨道“头碰头重叠构建而成,试讨论Li训(气态分子) HC、C,分子里的键分别属于哪一种? 答:LiH是s一so健:HCI是s一pG健:C是p一pG键。 0药分子里有几个健?它门的电子云在取向上存在什么关系?用圈形精之 键, 互相垂直的关系。如图所示 10.5用VSEPR模型讨论CO,、H,O、NH,、CO 、PO、PO 、P0的分子模型,画出它们 的立体结构,用短横代表分子的键骨架,标明分子构型的几何图形名称: 答: 分子式 杂花方式 立体结构 分子构型 CO: 0=C=0 直线型 HO sp V型 H H NH, sp 三角锥 co- 平面三角形 0 0 PO 。8o 三角维 0 sp 平面三角形
O S O O O 2 S O O O O 2 也有的教科书将所有硫和氧原子之间的被都画成 S 指向氧原子的箭头。应当注意到的事实 是,硫酸根中硫原子和氧原子之间的化学键明显具有双键的性质,用单键表达,是明显偏 离事实的。从形式电荷的角度,上面的两根双键的路易斯结构式的硫原子和两个氧原子都 是零,另外两个氧原子因获得外加的电子而呈-1,是最合理的,而四根单键的结构式,形 式电荷为 S +2 ,O-1 ,也是可以成立的。这是路易斯结构式不能克服的内在矛盾。 10.3 σ键可由 s-s、s-p 和 p-p 原子轨道“头碰头”重叠构建而成,试讨论 LiH(气态分子)、 HCl、Cl2分子里的σ键分别属于哪一种? 答:LiH 是 s-sσ键:HCl 是 s-pσ键;Cl2 是 p-pσ键。 10.4 N2 分子里有几个π键?它们的电子云在取向上存在什么关系?用图形描述之。 答: 有两个π键,互相垂直的关系。如图所示: 10.5 用 VSEPR 模型讨论 CO2、H2O、NH3、CO3 2- 、PO3 3- 、PO3- 、PO4 3- 的分子模型,画出它们 的立体结构,用短横代表分子的σ键骨架,标明分子构型的几何图形名称。 答: 分子式 杂花方式 立体结构 分子构型 CO2 sp O C O 直线型 H2O sp 3 O H H V 型 NH3 sp 3 N H H H 三角锥 CO3 2- sp 2 C O O O 平面三角形 PO3 3- sp 3 P O O O 三角锥 PO3- sp 2 P O O O 平面三角形

sp 四面体 -o 10.6讨论上题列举的分子(或离子)的中心原子的杂化类型。 答:见上表。 解的,因为杂化轨道理论是对分子立体结构的解释,而分子的立体结构是由中心原子周 围有多少个σ轨道(包括孤对电子在内)决定的,由此也可以理解为什么我们不必讨论端位 原子的杂化类型,因为端位原子不影响分子的立体结构。 10.7 丙烷分子中的所有化学键都是单键(σ键),因而可以自由旋转。试问丙烷分子处在同一个 平面上的原子最多可以达几个?若你不能在纸面上讨论,或不敢确认自己的结论,请用立 体分子模型来讨论(用黏土和木棍搭模型最省钱:搭模型有助于更好地掌握立体结构知识, 但用模型讨论完后仍要在纸面上画图描述)。 33 答:5个,如图所示 包含3个碳原子的平面同时包含2个氢原子。 10.8 CH叫金刚烷,它的衍生物一金刚胺是抗病毒药物。请问:金刚烷分子里有几个六元环 这些六元环都相同吗?试设想:把金刚烷分子装进一个空的立方体里,分子的次甲基 CH一)上的碳原子位于立方体面心位置。分子中的一CH一基团的碳原子将处在什么立 方体的什么位置?金刚烷中的氢原子各取什么方向?在解题或搭模型时不要忘记借用 杂化轨道的概念。 答: 4个:相同。如图所示 ○代表碳原子,○代表氢原子 10.9借助VSEP模型、杂化轨道模型、元键与σ键、大π键以及等电子休等概念,讨论OF2 CIF;、SOCl2、XeF2、SFs、PCl5的分子结构. 答:
PO4 3- sp 3 P O O O O 四面体 10.6 讨论上题列举的分子(或离子)的中心原子的杂化类型。 答: 见上表。 评注:当中心原子有孤对电子时,其 VSEPR 模型与分子立体结构是不同的,而中心原子 的杂化类型与 VSEPR 模型对应。杂化轨道只用于形成σ键不用于形成 π 键,这是不难理 解的,因为杂化轨道理论是对分子立体结构的解释,而分子的立体结构是由中心原子周 围有多少个σ轨道(包括孤对电子在内)决定的,由此也可以理解为什么我们不必讨论端位 原子的杂化类型,因为端位原子不影响分子的立体结构。 10.7 丙烷分子中的所有化学键都是单键(σ键),因而可以自由旋转。试问丙烷分子处在同一个 平面上的原子最多可以达几个?若你不能在纸面上讨论,或不敢确认自己的结论,请用立 体分子模型来讨论(用黏土和木棍搭模型最省钱: 搭模型有助于更好地掌握立体结构知识, 但用模型讨论完后仍要在纸面上画图描述)。 答: 5 个,如图所示 包含 3 个碳原子的平面同时包含 2 个氢原子。 10.8 C10H6 叫金刚烷, 它的衍生物―金刚胺是抗病毒药物。 请问: 金刚烷分子里有几个六元环? 这些六元环都相同吗?试设想: 把金刚烷分子装进一个空的立方体里, 分子的次甲基(- CH2-)上的碳原子位于立方体面心位置。分子中的-CH-基团的碳原子将处在什么立 方体的什么位置?金刚烷中的氢原子各取什么方向?在解题或搭模型时不要忘记借用 杂化轨道的概念。 答: 4 个;相同。如图所示: 10.9 借助 VSEPR 模型、杂化轨道模型、π 键与σ键、大 π 键以及等电子体等概念,讨论 OF2、 ClF3 、SOCl2 、XeF2 、SF6 、PCl5 的分子结构. 答:
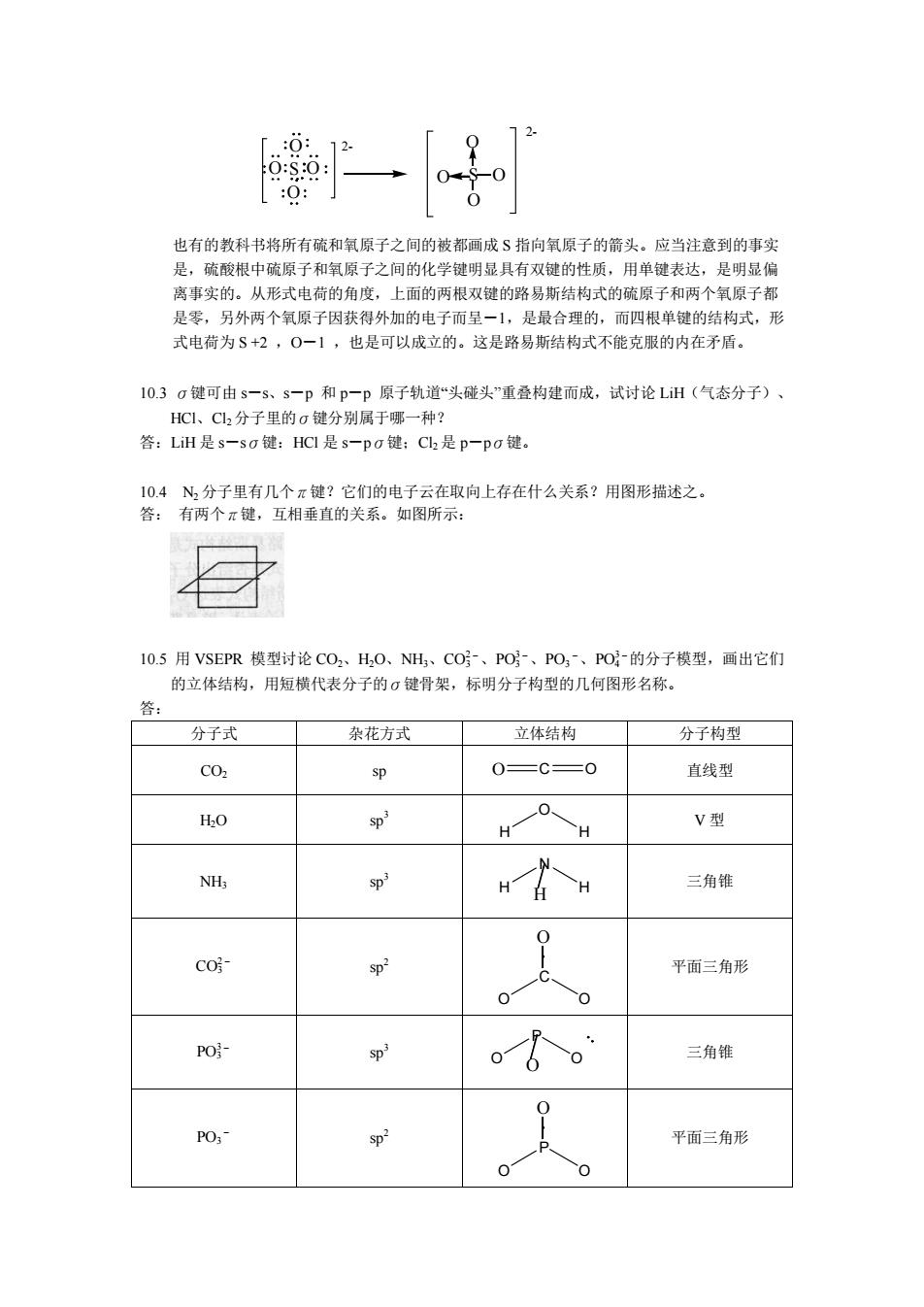
分子 杂化类型 VSEPR 立体结构 OF SD* AY V型 sp'd AYs T型 SOCL SD' AY 三角锥 dsp AY, 直线型 SF6 sp'd- AY 八面体 PCls sp'd AYs 三角双锥 10.10有一种叫做丁三烯的平面分子,请根据其名称画出路易斯结构式,标明分子的价电子总数, 再讨论分子中碳原子的杂化轨道、碳碳键的健角、π键或大π键的取向。用图形来答 答: 16e 如下图: H sp2 spsp sp2 H 120°C=C =C120 H 180°180 H 评注:用chemsketch程序进行结构优化,可得到如下结果: H,C=C=CH2 H2C=C=CH2 H2C=C=C= CH 由此可发现规律:当这类烯分子的碳原子为偶数时,所有原子在一个平面上,否则氢原子 不同面 10.11实验证明,臭氧离子03的健角为100°,试用VSEPR模型解释之,并推侧其中心氧原子 的杂化轨道类型。 答:O3-VSEPR AX.E=AXE=AY,四面体:孤对电子相斥使 ∠0-0-0<10928sp3杂化 评注:臭氧分子的实测键角为116.5°,因而有极性,这是由于:中心原子和端位原子因氧 化态不同而电负性不同,端位原子呈负电,与中心原子上的孤对电子的偶极方向相反,故 极性很小。参考18题
分子 杂化类型 VSEPR 立体结构 OF2 sp 3 AY4 V 型 ClF3 sp 3d AY5 T 型 SOCl2 sp 3 AY4 三角锥 XeF2 dsp 3 AY5 直线型 SF6 sp 3d 2 AY6 八面体 PCl5 sp 3d AY5 三角双锥 10.10 有一种叫做丁三烯的平面分子, 请根据其名称画出路易斯结构式, 标明分子的价电子总数, 再讨论分子中碳原子的杂化轨道、碳碳键的键角、π 键或大 π 键的取向。用图形来答 答: 16e ;如下图: C C C C H H H H 120° 120° 180° 180° sp2 sp sp sp 2 评注:用 chemsketch 程序进行结构优化,可得到如下结果: H 2 C C CH 2 H 2 C C CH 2 C C C CH H 2 C 2 由此可发现规律:当这类烯分子的碳原子为偶数时,所有原子在一个平面上,否则氢原子 不同面。 10.11 实验证明,臭氧离子 O 3- 的健角为 100°,试用 VSEPR 模型解释之,并推侧其中心氧原子 的杂化轨道类型。 答: O 3- VSEPR AX2E1.5=AX2E2=AY4四面体;孤对电子相斥使 –O - O - O < 109°28' sp 3 杂化 评注:臭氧分子的实测键角为 116.5° ,因而有极性,这是由于:中心原子和端位原子因氧 化态不同而电负性不同,端位原子呈负电,与中心原子上的孤对电子的偶极方向相反,故 极性很小。参考 18 题

10.12第二周期同核双原子分子中那些不能稳定存在?那些有磁性?试用分子轨道模型解释之。 答: Be,不能稳定存在,分子轨道组态为©]02a*公2键级为零 B2,O2有顺磁性 分了轨道组态分别为: B,:He10,20*,2π-'元. 02:H,1,2g*202222元11 评注:实验观察到的C2分子有顺磁性,这一事实可以通过分子轨道理论解释如下:C2分子 的基态分子轨道中的最高占有轨道和最低未占轨道之间的能量差较小,部分C,分子可发生 单电子跃迁得到它的 激发态如下图所示 2p 2 北20 2 t 1 该激发态C分子具有未成对电子,因而具有顺磁性。附带还可提及,激发态的双碳分子的 键级跟基态是相等的(激发态双碳分子的最高电子占有轨道也是一个成键轨道)。 用分子轨道理论对第二周期同核双原子分子的键能的预言可参考下图: B2 20 0函 1c2 497 700 ☒2 3 由此图可见C容易形成激发态,此外,从此图也可见,5的键能很小,是活泼分子,N的 键能最大,是最惰性的分子(图中标注了各种分子的键级和键能数据,此图源自tp: ww.batnet.com)
10.12 第二周期同核双原子分子中那些不能稳定存在?哪些有磁性?试用分子轨道模型解释之。 答: Be2 不能稳定存在,分子轨道组态为[He2]σ2s2σ*2s2 键级为零。 B2,O2 有顺磁性 ,分子轨道组态分别为: B2:[He2]σ2s2σ*2s2π2px 1π2py 1 O2:[He2]σ2s2σ*2s2σ2p 2π2px 2π2py 2π2px 1π2py 1 评注:实验观察到的 C2分子有顺磁性,这一事实可以通过分子轨道理论解释如下:C2 分子 的基态分子轨道中的最高占有轨道和最低未占轨道之间的能量差较小,部分 C2 分子可发生 单电子跃迁得到它的激发态如下图所示: 该激发态 C2 分子具有未成对电子,因而具有顺磁性。附带还可提及,激发态的双碳分子的 键级跟基态是相等的(激发态双碳分子的最高电子占有轨道也是一个成键轨道)。 用分子轨道理论对第二周期同核双原子分子的键能的预言可参考下图: 由此图可见 C2容易形成激发态,此外,从此图也可见,F2 的键能很小,是活泼分子,N2 的 键能最大,是最惰性的分子(图中标注了各种分子的键级和键能数据,此图源自 http//; www.batnet.com)

10.130,、02、02ˉ、0-的实测键长越来越长,试用分子轨道理论解释之。其中哪几种有顺磁 性?为什么? 答: 0、02、02-、02-轨道电子数分别为1、2、3、4,键级分别为2.5、2.0、1.5 1.0,分子因反键轨道填充的电子数增多,键级减小,导致键长增长、稳定性降低。前3种 子有未成对电子,故有顺磁性。 10.14试用分子轨道模型作出预言,O的键长与O2的健长哪个较短,N2的健长与N2的健 长哪个较短?为什么? 答:02:He]a22*22p2p2n2*'键级为25 O2:He02g*2g2p2x*2'x*2:键级为2,键级越小,键长越长。 N:e22a*e20p健级为2 N:eo2*22pm元m2on2键级为0,故N的键长比N,短 10.15计算表明.CO、N0的分子轨道能级图中的0,轨道和p轨道的顺序跟N,分子轨道里 的顺序相同。它们有没有顺磁性?计算它们的键级,并准测它们的键长顺序 答: C0与等电子(I0e),无未成对电子,故无顺磁性:N0是1e分子,有1e, 顺磁性,CO的键级是3,NO的键级是25,键级降低,键长增大,因而C0键的 比NO短。 6为计么太红键中的电子数达到数道致的2倍整个大红键营会游透 键级为零。 10.17偶极矩的SI制单位为C·m,有的教材已经用10-0cm代替D作为键矩和分子偶极矩 的单位,其数值的数量级与用德拜为单位是相同的,但数值却不同,为免相混,请计算 德拜与10-”库仑·米的换算系数. 答: 1D=10-.esu·cm=10-.3.335·10-1℃·10-2m-3.335·10-0C·m 10.18NF;和NH的偶极矩相差很大,试从它们的组成和结构的差异分析原因 答:NF3和NH的偶极矩分别为024和148,对于NH,因为氮的电负性大于氢原子, 偶极矩的方向指向氮原子,而孤对电子的取向与之一致,使偶极矩更大:对于NF,因F 的强电负性使偶极矩指向氟原子,而孤对电子的取向与之相反,使偶极矩变小。 评注:O,的偶极矩也由于跟NF;相同的原因而较小。 10.19CH2的偶极矩等于零,而通式相同的HO2的偶极矩等于2.1D,大于HO的偶极知 (185D),试根据偶极矩的实测结果推侧CH和H,O2的分子立体结构。 答: HC■CH,分子星平面结构,有对称中心,偶极矩为零,H,O,分子的H一O一O夹角应 接近水分子的H一0一H夹角,无论2个0一H键在不在一个平面内,都跟氧原子的视 对电子取向相反,因而有较高偶极矩(如图): a 评注:氢氧键不在一个平面上的过氧化氢是较稳定的结构。用chemdraw附带的计算程序 进行能量最小化处理很容易验证这一点
10.13 O2+ 、O2、O2- 、O2 2- 的实测键长越来越长,试用分子轨道理论解释之。其中哪几种有顺磁 性?为什么? 答: O2+ 、O2、O2- 、O2 2- 轨道电子数分别为 1、2、3、4 ,键级分别为 2.5 、2.0 、1.5 、 1.0 , 分子因反键轨道填充的电子数增多, 键级减小, 导致键长增长、 稳定性降低。 前 3 种 子有未成对电子,故有顺磁性。 10.14 试用分子轨道模型作出预言,O2+ 的键长与 O2 的键长哪个较短,N2+ 的键长与 N2 的键 长哪个较短?为什么? 答: O2+ :[He2]σ2s2σ*2s2σ2p 2π2px 2π2py 2π*2px 1 键级为 2.5 O2:[He2]σ2s2σ*2s2σ2p 2π2px 2π2py 2π*2px 1π*2py 1;键级为 2,键级越小,键长越长。 N2+ :[He2]σ2s2σ*2s2π2px 2π2py 2σ2p 1 键级为 2 N2:[He2]σ2s2σ*2s2π2px 2π2py 2σ2p 2 键级为 0,故 N2+ 的键长比 N2 短。 10.15 计算表明.CO、NO 的分子轨道能级图中的σ2p轨道和 π2p 轨道的顺序跟 N2 分子轨道里 的顺序相同。它们有没有顺磁性?计算它们的键级,并推测它们的键长顺序。 答: CO 与 N2 等电子(10e ) ,无未成对电子,故无顺磁性;NO 是 11e 分子,π2p*有 1e, 有 顺磁性,CO 的键级是 3 , NO 的键级是 2.5 ,键级降低,键长增大,因而 CO 键长 比 NO 短。 10.16 为什么大 π 键中的电子数达到轨道数的 2 倍,整个大 π 键就会崩溃? 答: 键级为零。 10.17 偶极矩的 SI 制单位为 C· m ,有的教材已经用 10-30Cm 代替 D 作为键矩和分子偶极矩 的单位,其数值的数量级与用德拜为单位是相同的,但数值却不同,为免相混,请计算 德拜与 10-30 库仑· 米的换算系数. 答: 1D = 10-18·esu·cm =10-18·3.335·10-10C·10-2m=3.335·10-30 C·m 10.18 NF3 和 NH3 的偶极矩相差很大,试从它们的组成和结构的差异分析原因。 答: NF3 和 NH3 的偶极矩分别为 0.24 和 1.48 ,对于 NH3,因为氮的电负性大于氢原子, 偶极矩的方向指向氮原子,而孤对电子的取向与之一致,使偶极矩更大;对于 NF3 因 F 的强电负性使偶极矩指向氟原子,而孤对电子的取向与之相反,使偶极矩变小。 评注:O3 的偶极矩也由于跟 NF3相同的原因而较小。 10.19 C2H2 的偶极矩等于零,而通式相同的 H2O2的偶极矩等于 2.1D ,大于 H2O 的偶极矩 ( l.85D ) ,试根据偶极矩的实测结果推侧 C2H2 和 H2O2 的分子立体结构。 答: H2C = CH2 分子呈平面结构,有对称中心,偶极矩为零,H2O2分子的 H-O-O 夹角应 接近水分子的 H-O-H 夹角,无论 2 个 O-H 键在不在一个平面内,都跟氧原子的孤 对电子取向相反,因而有较高偶极矩(如图): 评注:氢氧键不在一个平面上的过氧化氢是较稳定的结构,用 chemdraw 附带的计算程序 进行能量最小化处理很容易验证这一点

1020二氯乙烯有3种同分异构体,其中一种偶极矩等于零,另两种偶极矩不等于零。试推 测它们的分子结构,作出必要的解释,并在结构式下标示偶极矩大小的顺序。 偶极矩: > C、 1021下图所示分子的实测偶极矩为15D,已知C一S键的键矩为0,9D,试推测该分子的可能 立体结构 答:因为15D>09D,故两个原子应在苯环的同一侧:可能该分子2个S原子都不在苯环 平面内,可形象地称为蝴蝶状分子 用chemdraw制作的经能量最小化处理后的立体结构图如下: 10.22水的实测偶极矩为1.85D,己知H一0键的键矩为1.51D,H,0的实测键角为104.5, 借助矢里加和法由H一0键矩计算水分子偶极矩。 解: u(H,0)=2u(H-O)c0s(01/2)=2x151 Dxcos(104.5°/2)=1.85D 答:水分子偶极矩的偶极矩为1.85D。 1023一氧化碳分子与醛酮的羰基(>C-0)相比,键能较大,键长较小,偶极矩则小得多,且 方向相反,试从结构角度作出解释。 答:对于C0 ,C原子和0原子成键时不仅形成2个共用电子对,而且氧原子上的已经成对的 电子还要进入碳原子的空轨道(配位键),使碳原子反而呈负电性,该偶极与氧较大电负 性吸引电子是相反的,因此C0分子的偶极矩接近零。 评注:CO分子的碳原子相对呈负电,因而羰基化合物如N(CO,:的配位原子是碳而不是氧。 1024极性分子一极性分子、极性分子一非极性分子、非极性分子一非极性分子,共分子间的范 德华力各如何构成?为什么? 答: 取向 分子类型 诱导力 色散力 极性一极性分子 有 极性一非极性分子 有 有 无 有 非极性分子一非极性分子
10.20 二氯乙烯有 3 种同分异构体,其中一种偶极矩等于零,另两种偶极矩不等于零。试推 测它们的分子结构,作出必要的解释,并在结构式下标示偶极矩大小的顺序。 答: 偶极矩: Cl Cl Cl Cl Cl Cl > > 10.21 下图所示分子的实测偶极矩为 1.5D ,已知 C-S 键的键矩为 0.9D,试推测该分子的可能 立体结构。 S S 答:因为 1.5D > 0.9D ,故两个硫原子应在苯环的同一侧;可能该分子 2 个 S 原子都不在苯环 平面内,可形象地称为“蝴蝶状分子。 用 chemdraw 制作的经能量最小化处理后的立体结构图如下: 10.22 水的实测偶极矩为 1.85D ,己知 H-O 键的键矩为 1.51D , H2O 的实测键角为 104.5°, 借助矢里加和法由 H-O 键矩计算水分子偶极矩。 解: m (H2 O) = 2m (H -O) cos(q / 2) = 2¥1.51D¥cos(104.5°/ 2) =1.85D 答: 水分子偶极矩的偶极矩为 1.85D 。 10.23 一氧化碳分子与醛酮的羰基(>C=O)相比,键能较大,键长较小,偶极矩则小得多,且 方向相反,试从结构角度作出解释。 答: 对于 CO ,C 原子和 O 原子成键时不仅形成 2 个共用电子对,而且氧原子上的已经成对的 电子还要进入碳原子的空轨道(配位键),使碳原子反而呈负电性,该偶极与氧较大电负 性吸引电子是相反的,因此 CO 分子的偶极矩接近零。 评注:CO 分子的碳原子相对呈负电, 因而羰基化合物如 Ni(CO)4的配位原子是碳而不是氧。 10.24 极性分子-极性分子、极性分子-非极性分子、非极性分子-非极性分子,其分子间的范 德华力各如何构成?为什么? 答: 分子类型 取向 力 诱导力 色散力 极性-极性分子 有 有 有 极性-非极性分子 非极性分子-非极性分子 无 有 有 无 无 有
取向力是固有偶极之间的作用力,非极性分子没有固有偶极,因而只有极性分子和极性分 子之间的范德华力有取向力的成分:诱导力是固有偶极诱导产生的偶极,因此非极性分子 之间没有诱导力的成分,而色散力是瞬时偶极之间的作用力,因此任何分子间都存在色散 力。 评注:应明确:对绝大多数分子而言,色散力是范德华力的主要来源。 1025考察HC1、HB、H的色散力、取向力、诱导力以及它们构成的范德华力的顺序,并作 出解释 答:取向力:HC>HB>H:因为HC、HBr、HⅢ偶极矩依次减小,故取向力依次减小: 诱导力:HC>HB>H:因为偶极矩越大,诱导力也越大: 色散力:HC1<HB<:因为分子的极化率越大,变形性越大,色散力越大 周期系从上到下,主族非金属元素的范德华半径依次增大(但p区和d区的金属元素则 不尽然),从左到右依次减小,而且,当增加新的能级时,半径有较明显的变化。 1027氟化氢分子之间的氢键键能比水分子之间的键能强,为什么水的熔、沸点反而比氟化氧的 馆推古年9 答: 每摩H,0分子平均有2m0l氢键,比H亚间的氢键数多一倍。 10,28为什么邻羟基苯甲酸的熔点比间羟基苯甲酸或对羟基苯甲酸的熔点低? 答:邻羟基苯甲酸分子内形成氢键,间羟基苯甲酸和对羟基苯甲酸分子间形成氢键。 10.29温度接近沸点时,乙酸蒸气的实测分子量明显高于用原子量和乙酸化学式计算出来的分子 量。为什么?乙醛会不会也有这种现象? 答: 部分气态乙酸分子因氢键而缔合成(CHCO○H)2,乙醛分子没有形成氢键的条件。 *10.30根据对称性的概念,以下哪些分子有手性,哪些分子有极性? S、NS4、CH-CH、HO(非平面结构)、CHCI=CHCI、CH、HSO4、HNO、SO H0C1。 答:如下表 CH:- CHCI=CHCI C.H HNO;HSO SO;HOCI CH C C D 像) 顺式反式 无 无 无 右 性 无 无 无 无 有 有 有
取向力是固有偶极之间的作用力,非极性分子没有固有偶极,因而只有极性分子和极性分 子之间的范德华力有取向力的成分;诱导力是固有偶极诱导产生的偶极,因此非极性分子 之间没有诱导力的成分,而色散力是瞬时偶极之间的作用力,因此任何分子间都存在色散 力。 评注:应明确:对绝大多数分子而言,色散力是范德华力的主要来源。 10.25 考察 HCl、HBr 、HI 的色散力、取向力、诱导力以及它们构成的范德华力的顺序,并作 出解释。 答:取向力:HCl>HBr>HI;因为 HCl、HBr 、HI 偶极矩依次减小,故取向力依次减小; 诱导力:HCl>HBr>HI;因为偶极矩越大,诱导力也越大; 色散力:HCl<HBr<HI;因为分子的极化率越大,变形性越大,色散力越大。 10.26 元素的范德华半径随周期系从上到下、从左到右有何变化规律? 答: 周期系从上到下,主族非金属元素的范德华半径依次增大(但 p 区和 d 区的金属元素则 不尽然),从左到右依次减小,而且,当增加新的能级时,半径有较明显的变化。 10.27 氟化氢分子之间的氢键键能比水分子之间的键能强,为什么水的熔、沸点反而比氟化氢的 熔沸点低? 答: 每摩 H2O 分子平均有 2mol 氢键,比 HF 间的氢键数多一倍。 10.28 为什么邻羟基苯甲酸的熔点比间羟基苯甲酸或对羟基苯甲酸的熔点低? 答: 邻羟基苯甲酸分子内形成氢键,间羟基苯甲酸和对羟基苯甲酸分子间形成氢键。 10.29 温度接近沸点时,乙酸蒸气的实测分子量明显高于用原子量和乙酸化学式计算出来的分子 量。为什么?乙醛会不会也有这种现象? 答: 部分气态乙酸分子因氢键而缔合成(CH3COOH)2,乙醛分子没有形成氢键的条件。 *10.30 根据对称性的概念,以下哪些分子有手性,哪些分子有极性? S8、N4S4、CH3-CH3、H2O2(非平面结构)、CHCl=CHCl、C6H6、H2SO4、HNO3、SO3 、 HOCl。 答:如下表 S8 N4S4 CH3- CH3 H2O2 CHCl=CHCl C6H6 HNO3 H2SO4 SO3 HOCl 对 称 性 D4 D4 D3h D3v(交 叉构 像) C2 C2V C2h D6h Cs 见附 图 D3h Cs 手 性 无 无 无 有 顺式 反式 无 无 无 无 无 无 无 极 性 无 无 无 有 有 无 无 有 有 无 有
