
第11章卤素 1山电解制氟时,为何不用KF的水溶液?液态氟化氢为什么不导电,而氯化钾的无水氟化氢 溶液却能导电? 解:由于氟的高还原电位(E-2.87V,氟遇水时会同水发生反应。因此,制备单质F,不 能用KF的水溶液。电解制氟的反应方程式是: 2Km电解2KF1H+F51 液态氟化氢不导电,但氣化钾的无水氟化氢溶液能导电,是因为液态氟化氢可同无水氟化钾 作用形成KHF2,该物质可发生强的电离作用,产生正负离子,从而导电。 KHF:→K*+HF, 本质上,无水氟化氢是溶剂,氟化钾是溶解于氟化氢的溶质,该体系是非水H证溶剂(也 是类水溶剂)的电解质溶液。 112氟在本族元素中有哪些特殊性?氟化氢和氢氯酸有哪些特性? 解:同同族其它元素相比,氟元素的特殊性主要有: (1)除单质外,氟的氧化态呈一1价,不呈正氧化态(其它卤素有多种氧化态):氟有特别强 的氧化性: (2氟的电了亲合能比氯小(从氯到又逐渐减小)。 (3)F的键能因孤对电子的影响而小于C2。 (4)同其它的HⅨ在室温时是双原子气体相比,氟化氢是一种由氢键引起的聚合多原子气体 亚X。与同族其它元素的氢化物相比,由于氟化氢分子间存在强的氢键,其培点、沸点、 汽化热和热力学稳定性都特别高。HF的高介电常数、低黏度和宽的液态范围,使它是各 种类型化合物的一种极好溶剂。许多M、M和M严的离子性化合物在亚中溶解后由于 易离解而得到高效导电的溶液(XeF,HSOF,SF6及M6(M:Mo、W、U、R Os)在HF中可溶解但不离解) (5)氟化氢的水溶液即氢氟酸。同其它氢卤酸是强酸相比,氢氯酸的 酸性较弱: HF+HHO'+F- K92.4~4.7×10-4 HF+F k=525 与共它弱酸相似。F浓度越稀,共电离常数越大。但是,随着亚浓度的增加,体系的 酸度增大。当浓度>5mol.dm3时,氢氟酸便是一种相当强的酸. (6)无论HF(g),还是氢氟酸,都可问SiO2作用,其它HX无此性质。 ()HOF跟HOC,HOBr,HOI不同,不是酸。 (8)氟化物的溶解度与共他卤化物明显不同,如NF溶解度较小,而其他NaX易溶,又如, Ca2难溶,而其他CaX易溶。 11.3(I)根据电极电势比较KMhO,、K,Cr,O,和MnO2与盐酸(mol~dm-)反应而生成的反应 趋势。 (2)若用MO2与盐酸反应,使能顺利地发生C2,盐酸的最低浓度是多少? 解:(1)渣酸表:82C=1.358v EStnOF /Mn=1.491V E8,oic3=1.33V E8Mn02M24=l.228V
第 11 章卤素 11.l 电解制氟时,为何不用 KF 的水溶液?液态氟化氢为什么不导电,而氟化钾的无水氟化氢 溶液却能导电? 解:由于氟的高还原电位(E y F2/F-=2 . 87V) ,氟遇水时会同水发生反应。因此,制备单质 F2不 能用 KF 的水溶液。电解制氟的反应方程式是: 2KHF2 === 2KF↑+H2 + F2↑ 液态氟化氢不导电,但氟化钾的无水氟化氢溶液能导电, 是因为液态氟化氢可同无水氟化钾 作用形成 KHF2,该物质可发生强的电离作用,产生正负离子,从而导电。 KHF2 K + + HF2- 本质上,无水氟化氢是溶剂,氟化钾是溶解于氟化氢的溶质,该体系是非水 HF 溶剂(也 是类水溶剂)的电解质溶液。 11.2 氟在本族元素中有哪些特殊性?氟化氢和氢氟酸有哪些特性? 解:同同族其它元素相比,氟元素的特殊性主要有: ( l )除单质外,氟的氧化态呈-l 价,不呈正氧化态(其它卤素有多种氧化态);氟有特别强 的氧化性; ( 2)氟的电子亲合能比氯小(从氯到碘又逐渐减小)。 ( 3 ) F2 的键能因孤对电子的影响而小于 Cl2 。 ( 4 )同其它的 HX 在室温时是双原子气体相比,氟化氢是一种由氢键引起的聚合多原子气体 (HF )x。与同族其它元素的氢化物相比,由于氟化氢分子间存在强的氢键,其熔点、沸点、 汽化热和热力学稳定性都特别高。HF 的高介电常数、低黏度和宽的液态范围,使它是各 种类型化合物的一种极好溶剂。许多 M I 、M II 和 M III 的离子性化合物在 HF 中溶解后由于 易离解而得到高效导电的溶液( XeF2, HSO3F , SF6 及 MF6 ( M:Mo 、W 、U 、Re 、 Os )在 HF 中可溶解但不离解) ( 5 )氟化氢的水溶液即氢氟酸。同其它氢卤酸是强酸相比,氢氟酸的 酸性较弱: HF + H2 H3O + + F- K1 2.4~4.7×10-4 HF + F- HF2- K2 =5~25 与其它弱酸相似,HF 浓度越稀,其电离常数越大。但是,随着 HF 浓度的增加,体系的 酸度增大。当浓度>5mol. dm-3 时,氢氟酸便是一种相当强的酸。 ( 6 )无论 HF( g ) ,还是氢氟酸,都可同 SiO2作用,其它 HX 无此性质。 ( 7 ) HOF 跟 HOCI , HOBr ,HOI 不同,不是酸。 ( 8 )氟化物的溶解度与其他卤化物明显不同,如 NaF 溶解度较小,而其他 NaX 易溶,又如, CaF2 难溶,而其他 CaX2 易溶。 11.3 ( l )根据电极电势比较 KMnO4 、K2Cr2O7 和 MnO2与盐酸(l mol ·dm -3) 反应而生成的反应 趋势。 (2)若用 MnO2 与盐酸反应,使能顺利地发生 Cl2,盐酸的最低浓度是多少? 解: ( 1 )查酸表:E y Cl2/Cl-=1.358V E y MnO 4- /Mn 2+ =1.491V E y Cr2O 7 2- /Cr 3+=1.33V E y MnO2/Mn 2+=1.228V 电解

所以KMnO,能氧化C-得到C,而K,Cr,O、MhO2在盐酸浓度为Imoldm-3时不能 反应,只能氧化浓盐酸中的C, (2)求盐酸的最低浓度[H门 MnO:+4H'+2e +2H0 E°=1228V Cl2+2e°→2C1 E9=1.358V MnoiM+0.059/2-lg [H [Mnc/C+0.0592-lg(pCh/pey [a-P [Mn"]-Imol -dm-3=1 在HCI中,[r]-[C,故 0.0s9/2-0g[Fj'-lg/[F了2pcc-p°M0Mm2 则0.059/21g[H≥1.358-1.288≥0.13 lg[H]≥0.734 [H]542 mol-m 11.4根据电势图计算在298K时,Br在碱性水溶液中歧化为B和BO,的反应平衡常数。 0.159 1.065 解:BrO- -Br 3 Br+60H-=5 Br-+BrOj+3H2O 1eK9=nE90.059=5×1.065-0.519y0.059=46.27 K9-1.87x10 11.5三氟化氮NF,(沸点一129℃)不显Lewis碱性,而相对分子质量最低的化合物NH,(沸点 一33C)却是个人所共知的Lwis碱.(a)说明它们挥发性差别如此之大的原因:(b)说明它 们碱性不同的原因。 解:(a)NF,的挥发性较NH低,主要是由于氨气中NH分子间存在较强的氢键,使其不易挥 发,因而沸点较NF:高。 (b)NH的碱性强于NF·从结构式来看,它们均为三角锥形,表观上N均有一孤对电子, 但NF,分子中,由于F的强吸电子能力,使得N上的电子密度减瑚,同质子等Lwis酸 结合的能力减小 NH,中N周围的电子密度较NF,的N要大很多, 故碱性强。 11.6肉盐中制取B,可用氯气氧化法。不过从热力学观点看Br~可被O2氧化为B2,为什么不 用O2米制取B2? 解: Br-用C12氧化 Cl2(g)+2Br-(aq)-2CI-(aq)+Bra(g) -1.07 026 得到的挥发性B,以蒸汽 -空气混合物形式离开体系,从热力学角度B~在酸性溶液中 可被0,所氧化: O(g)+4Br(aq+4H'(aq)→2HO(I+2Br(1)) E6=123-107=016V 但该反应在 h7的 液中不能进行 E==0. 5V) 尽管在碱性溶液中反应在力学上是有利的,但反应速率是否足够大则值得怀疑,这是因为 O,的反应将涉及到0.6V的过电位。即使在酸性溶液中反应速率也较大的话,但由于需要将 大量的盐卤酸化,然后又要将废液中和(环保要求),在经济上显然没有吸引力
所以 KMnO4 能氧化 Cl- 得到 Cl2,而 K2Cr2O7、MnO2在盐酸浓度为 lmol ·dm-3 时不能 反应,只能氧化浓盐酸中的 Cl- 。 ( 2 )求盐酸的最低浓度[H + ] MnO2+ 4 H + +2e- → Mn 2+ + 2H2O E y =1.228V Cl2 + 2e- →2Cl- E y = 1.358V φ MnO 4- /Mn 2+ + 0.059/2·lg[H + ] 4 /[Mn 2+ ]≥φ Cl2/Cl- + 0.059/2·lg(p Cl2/p )/[Cl- ] 2 [Mn 2+ ] = lmol ·dm -3 ,p Cl2/p = l 在 HCl 中,[H + ] =[Cl- ],故 0.059/2·(lg[H + ] 4- lg1/[H + ] 2 )≥φ Cl2/Cl--φ MnO4/Mn 2+ 则 0.059/2·lg[H + ] 6≥1.358-1.288≥0.13 lg[H + ] ≥0.734 [H + ] ≥5.42(mol ·dm -3) 11. 4 根据电势图计算在 298K 时,Br2 在碱性水溶液中歧化为 Br- 和 BrO3- 的反应平衡常数。 0.159 1.065 解: BrO3- Br2 Br- 3 Br2 + 6OH - = 5 Br- + BrO3- + 3H2O lgK y =n E y / / 0.059=5×(1.065-0.519)/0.059=46.27 K y =1.87×10 46 11.5 三氟化氮 NF3 (沸点-129 ℃ ) 不显 Lewis 碱性,而相对分子质量最低的化合物 NH3 (沸点 -33℃) 却是个人所共知的 Lewis 碱.( a )说明它们挥发性差别如此之大的原因;( b )说明它 们碱性不同的原因。 解: ( a ) NF3 的挥发性较 NH3 低,主要是由于氨气中 NH3 分子间存在较强的氢键,使其不易挥 发,因而沸点较 NF3高。 ( b ) NH3 的碱性强于 NF3。从结构式来看,它们均为三角锥形,表观上 N 均有一孤对电子, 但 NF3 分子中, 由于 F 的强吸电子能力, 使得 N 上的电子密度减弱, 同质子等 Lewis 酸 结合的能力减小;NH3 中 N 周围的电子密度较 NF3 的 N 要大很多,故碱性强。 11.6 卤盐中制取 Br2 可用氯气氧化法。不过从热力学观点看 Br- 可被 O2氧化为 Br2 ,为什么不 用 O2 来制取 Br2 ? 解: Br- 用 C12 氧化 C12 ( g ) + 2 Br- (aq )→2 CI- (aq )+ Br2( g ) E y =1.35-1.07=0.26V 得到的挥发性 Br2 以蒸汽——空气混合物形式离开体系,从热力学角度 Br- 在酸性溶液中 可被 O2 所氧化: O2( g ) + 4 Br- (aq )+4 H + (aq ) → 2 H2O( l )+ 2 Br2( l ) E y =1.23-1.07=0.16V 但该反应在 Ph=7 的溶液中不能进行(E==0 . 15V)。 尽管在碱性溶液中反应在力学上是有利的,但反应速率是否足够大则值得怀疑,这是因为 O2 的反应将涉及到 0.6V 的过电位。即使在酸性溶液中反应速率也较大的话,但由于需要将 大量的盐卤酸化,然后又要将废液中和(环保要求),在经济上显然没有吸引力

11.7通C12于消石灰中,可得漂白粉,而在漂白粉溶液中加入盐酸可产生C12,试用电极电势 说明这两个现象。 解: 136v C12 -CI- 0.40V 1.36V .C1 当C12通入消石灰溶液中时是碱性介质,Ec>a0a,Cl,可发生歧化反应: 2C12+2Ca (OH)2=Ca(C1O)2+CaCl2+2 HO 得到的产物是漂白粉。加盐酸到漂白粉溶液中,使体系酸化,此时,8/a-<co/c2'C1, 不能发生歧化反应,可发生的反应是C1,歧化反应的逆反应: +CaC12+2H0 11.8下列哪些氧化物是酸酐:OF2、C1,0,、C1O、C1,0、Br0和,O3,若是酸酐,写出 由相应的酸或其它方法得到酸酐的反应。 解:CIO是亚氯酸和氯酸的酸矸 C1,0是次氯酸的酸酐 C1,0,是高氯酸的酸 2O3是碘酸的酸酐 1,0s+H0 HCIO,PO,能水 =C1,02 -10°C 11.9如何鉴别KC10、KC1O,和KC1O,这三种盐? 解:取少量固体 加水溶解,如果溶液呈碱性,可知是次氯酸盐,因为三种酸根中,次氯酸根是 最强的碱,水解后呈碱性。若在碱性溶液中加入稀HS0酸化后,在光照下能分解出O,则 可知是次氯酸盐, C1O+H=HC1O 2HC10光照2HC1+O, 如果水溶液呈酸性,可知不是次氯酸盐。取少量固体,加入少量MO稍热,若有O2放出, 可知是氯酸盐 A 2HC10: 2HC1+202 如果没有上述实验现象,则可能是高氯酸盐.可往该周体的水溶液中加入含K试剂,有KCIO, 白色沉淀出现(加入酒精现象更明显),可证实是高氯酸盐。 1.10以2为原料写出制备HO、KIO、l2O和KI0,的反应方程式 解:(1)制HO4: 3b+6NaOH ==5Nal+NalO:+3H-O NalO:+Cl+3NaOH ==Na H:IO+2NaC
11.7 通 C12于消石灰中,可得漂白粉,而在漂白粉溶液中加入盐酸可产生 C12,试用电极电势 说明这两个现象。 解: 1.56V 1.36 V E y A C12 C1- 0.40V 1.36 V E y B C12 C1- 当 C12 通入消石灰溶液中时是碱性介质,E θ Cl2/Cl- >E θ ClO- /Cl2,C12 可发生歧化反应: 2C12 + 2Ca (OH)2= Ca(C1O) 2 + CaC12 + 2 H2O 得到的产物是漂白粉。 加盐酸到漂白粉溶液中, 使体系酸化, 此时,E y Cl2/Cl-< E y HClO/ Cl2, C12 不能发生歧化反应,可发生的反应是 C12 歧化反应的逆反应: Ca(C1O)2+ 4HCl = 2Cl2 + CaC12 + 2H2O 所以,上述两个反应是介质酸碱性的变化导致某些氧化还原反应方向改变的例证。 11.8 下列哪些氧化物是酸酐:OF2 、C12O7 、C1O2、C12O 、Br2O 和 I2O5 ,若是酸酐,写出 由相应的酸或其它方法得到酸酐的反应。 解: ClO2 是亚氯酸和氯酸的酸酐 C12O 是次氯酸的酸酐 C12O7是高氯酸的酸酐 I2O5是碘酸的酸酐 2HIO3 == I2O5 + H20 2C12 + 2HgO = HgC12·HgO + C12O(g) ClO3- + C1- + H + = ClO2+ 1/2 C12+ H2O HClO4============ C12O7 11.9 如何鉴别 KC1O 、KC1O3 和 KC1O4 这三种盐? 解:取少量固体,加水溶解,如果溶液呈碱性,可知是次氯酸盐,因为三种酸根中,次氯酸根是 最强的碱,水解后呈碱性。若在碱性溶液中加入稀 H2SO4 酸化后,在光照下能分解出 O2,则 可知是次氯酸盐. C1O- +H + = HC1O 2HC1O 2 HC1+ O2 如果水溶液呈酸性,可知不是次氯酸盐。取少量固体,加入少量 MnO2 稍热,若有 O2 放出, 可知是氯酸盐。 2HC1O3 2 HC1+ 2O2 如果没有上述实验现象, 则可能是高氯酸盐. 可往该固体的水溶液中加入含 K + 试剂, 有 KClO4 白色沉淀出现(加入酒精现象更明显),可证实是高氯酸盐。 11.10 以 I2为原料写出制备 HIO4、KIO3、I2O5 和 KIO4的反应方程式。 解: ( l )制 HIO4: 3 I2+ 6NaOH ==5NaI + NaIO3 + 3H2O NaIO3+ Cl2+ 3NaOH ==Na2H3IO6 + 2NaCl 443K H3PO4脱水 -10ºC 光照 Δ

Na:H:IOs+5AgNO;=AgsIO.+2NaNO;+3HNO3 4AgsI06+10C2+10IH,0=4H5106+20AgC11+502 真空中: 2H10-3 H.0 372H0 工业上通过电解碘酸也可获得高碘酸。 (2)制KI0: 32+6KOH==5KI+KI0:+3H0 2+2KC10=2KI03+C2t 2HI03+02↑+4H20 (3)制1205:首先制HⅢ0 2+5C12+6H,0=2H01+10HC1 产物中HCI加AgO除去NO L+1OHNO.浓 =2HI0,+10N02+4H,0 由( 2H103+O2↑+4H0 由HⅢO加热分解得到0: 2HI0,43k1,0+H,0t 4制K10. 由(1)中得到的HO与KOH中和 HIO+KOH==KIO+H2O 11.11(1)2在水中的溶解度很小,试从下列两个半反应计算在298K时,2饱和溶液的浓度 1,(s)+2e-±21-:00=0.535V (aq)+2e一 2 2e=0621V (2)将0.100mol2溶解在100L0.100 mol dm-3K1溶液中而得到l5溶液,5生成反应的 Kc值为0.752,求15溶液中h的浓度。 解:(1)溶解反应2(9) 14aq)E=0.535-0.621=-0.086V 由1gKm=nE9/0.0592得 lgK=2×(-0.0860.0592=-2.905 1.24x10- 对于上述沉淀溶解平衡,其平街常数Kp=[山h】 所以=1.24×10- (2) I-(ag)+(s) -Ij (aq) (1)Kc=0.752 Ia(aq) (2)K-Kp=1.24x10- 则I广(aq)+l(aq) l5(aq)(3) K=Kc/Rsp=0.252/1.24×10-3=606.45 设溶液中2的浓度为x,。 I"(ag)+laa).slh(aa) 0.1-x (0.1-xr2=606.45 X=1.2x10-2 mol dm-3
Na2H3IO6+ 5AgNO3 ==Ag5IO6 + 2NaNO3 + 3HNO3 4Ag5IO6+ 10Cl2+ 10H2O == 4H5IO6 + 20AgCl↓+ 5O2 真空中: 2H5IO6 H4I2O9 2HIO4 工业上通过电解碘酸也可获得高碘酸。 ( 2 )制 KIO3: 3I2 + 6KOH ==5KI + KIO3 + 3H2O I2 + 2KClO3 == 2KIO3 + Cl2↑ 或由( l )中得到的 H5IO6 在 413K 时分解: 2H5IO6 ==== 2HIO3 + O2↑+ 4H2O ( 3 )制 I2O5:首先制 HIO3 I2 + 5Cl2+ 6H2O == 2HIO3 + 10HCl 产物中 HCl 加 Ag2O 除去 NO3- I2 + 10HNO3(浓)== 2HIO3 + 10 NO2+ 4H2O 由(1)中的到 H5IO6 在 413K 时分解: 2H5IO6 ==== 2HIO3 + O2↑+ 4H2O 由 HIO3 加热分解得到 I2O5: 2 HIO3 ===== I2O5+ H2O↑ ( 4 )制 KIO4: 由(1)中得到的 HIO4 与 KOH 中和 HIO4 + KOH===KIO4+ H2O 11.11 (1) I2 在水中的溶解度很小,试从下列两个半反应计算在 298K 时,I2 饱和溶液的浓度 I2 ( s ) + 2 e- 2I- ;φ = 0.535V I2 ( aq ) +2 e- 2I- ;φ = 0.621V ( 2 )将 0.100 mol I2 溶解在 l.00L 0.100mol·dm-3 KI 溶液中而得到 I3- 溶液,I3- 生成反应的 Kc 值为 0.752 ,求 I3- 溶液中 I2的浓度。 解:( l )溶解反应 I2 ( s) I2( aq ) E θ = 0.535-0.621=-0.086V 由 lg KSP = nE /0.0592 得 lg KSP = 2×(-0.086)/0.0592 = -2.905 KSP = 1.24×10-3 对于上述沉淀溶解平衡,其平街常数 Ksp = [ I2 ] 所以[I2] =1.24 × 10-3 ( 2 ) I- (aq) + I2(s) I3- (aq) (1)Kc=0.752 I2(s) I2(aq) (2) K=Ksp=1.24 x 10-3 则 I- (aq) + I2(aq) I3- (aq) (3) K3=Kc/Ksp=0.252/1.24 × 10-3= 606.45 设溶液中 I2 的浓度为 x .。 I- (aq) + I2(aq) I3- (aq) x x 0.1-x (0.1-x)/x 2=606.45 X=1.2×10-2 mol·dm-3 353K 373K -3H2O -H2O 413K 413K 413K

11.12利用电极电势解释下列现象:在淀粉碘化钾溶液中加入少量NaCI0时,得到蓝色溶液A, 加入过量NC1O时.,得到无色溶液B,然后酸化之并加少量用体Na,SO2于B落液,测A 的蓝色复现,当NSO,过量时蓝色又褪去成为无色溶液C,再加入O,溶液蓝色的A 溶液又出现。指出A、B、C各为何种物质,并写出各步的反应方程式。 解:A:2 B:IO C :I E号9m=0.535V E80a=0.81V E品512=0.234V 。品12=0.535W E89/2s03=0.172V 加少量NaCI0后,由于E吧oa->E号h,所以I被C0氧化为(蓝色),当NaCI0 过量时,由于801Cr>E品2所以h继续被氧化为10(无色),酸化并加入NaS0 后,由于E82>E9o-1so}-,所以10被S0还原为2,又显蓝色。当NaS0过量时, 由于E>E3o1s0,所以S0能将生成的k还原为。再加入a0,后,由于ER品: 12>号,所以I0能将I厂氧化成,本身也被还原成,各步反应方程式如下 (1)C10+21-+H0=1,+C1-+20H-(蓝色A) (2)5C10-+H,+20H-=5C1-+2I05+H,0(无色B) (3)2105+5S0-+H,0=2+5S0-+H,0(蓝色又复现) (4)+S0房+H0 2I+s0 (无色C) (5)51-+105+6r=3h+3,0(蓝色A复现) 11.13写出碘酸和过量,02反应的方程式,如在该体系中加入淀粉,会看到什么现象? 解:过氧化氢可还原碘酸为游离碘,碘遇淀粉变蓝色。 5H02+2H0 +5021+h+6H0 但一段时间后蓝色又会消失。 +5H02-2HI0+4H,0 1114写出三个具有共价键的金属卤化物的分子式,并说明这种类型卤化物的共同特性。 解: 这些卤化物的共同特点:熔、沸点一般较低。易挥发,能溶于非极性溶剂、在水中强烈水 解。 11.15什么叫多肉化物?与5离子比较,形成B、C1离子的趋势怎样? 解:卤化物与卤素单质或卤素互化物加合所生成的化合物称为多肉化物。与山,离子比较,形成 Br、C趋势逐渐减弱。 11.16什么是卤素互化物? (a)冯出CIF、BP;和P,等卤素互化物中心原子杂化轨道,分子电子构型和分子构型
11.12 利用电极电势解释下列现象: 在淀粉碘化钾溶液中加入少量 NaClO 时, 得到蓝色溶液 A , 加入过量 NaClO 时,得到无色溶液 B ,然后酸化之并加少量固体 Na2SO3 于 B 溶液,则 A 的蓝色复现,当 Na2SO3过量时蓝色又褪去成为无色溶液 C,再加入 NaIO3溶液蓝色的 A 溶液又出现。指出 A 、B 、C 各为何种物质,并写出各步的反应方程式。 解: A :I2 B :IO3- C :I- E y I2/I- = 0.535V E y ClO- /Cl- = 0.81V E y IO3- / I2 = 0.234V E y IO3- / I2 = 0.535V E y SO4 2- / H2 SO3 = 0.172V 加少量 NaClO 后,由于 E y ClO- /Cl->E y I2/I-,所以 I- 被 ClO - 氧化为 I2(蓝色),当 NaClO 过量时,由于 E y ClO- /Cl->E y IO3- / I2,所以 I2 继续被氧化为 IO3- (无色),酸化并加入 Na2SO3 后,由于 E y IO3- / I2 > E y SO4 2- / SO3 2- ,所以 IO3- 被 SO3 2- 还原为 I2,又显蓝色。当 Na2SO3 过量时, 由于 E y I2/I->E y SO4 2- / SO3 2- ,所以 SO3 2- 能将生成的 I2 还原为 I- 。再加入 NaIO3后,由于 E y IO 3 - / I2>E y I2/I- ,所以 IO3- 能将 I- 氧化成 I2 ,本身也被还原成 I2 ,各步反应方程式如下: ( 1 ) ClO - +2 I- +H2O = I2 + Cl- +2OH - (蓝色 A ) ( 2 ) 5 C1O- +I2+ 2OH - =5 Cl- +2 IO3- +H2O (无色 B ) ( 3 ) 2 IO3- +5 SO3 2- +H2O = I2 + 5SO4 2- +H2O(蓝色又复现) ( 4 ) I2 + SO3 2- +H2O =2 I- +SO4 2- +2H+ (无色 C ) ( 5 ) 5I- +IO3- +6 H + = 3 I2 + 3 H2O (蓝色 A 复现) 11.13 写出碘酸和过量 H2O2反应的方程式,如在该体系中加入淀粉,会看到什么现象? 解: 过氧化氢可还原碘酸为游离碘,碘遇淀粉变蓝色。 5H2O2+2 HIO3 → 5O2↑+I2 +6H2O 但一段时间后蓝色又会消失。 I2 +5 H2O2→2 HIO3+ 4H2O 11.14 写出三个具有共价键的金属卤化物的分子式,并说明这种类型卤化物的共同特性。 解: AlC13 , SnCl4 ,TiCl4 这些卤化物的共同特点:熔、沸点一般较低,易挥发,能溶于非极性溶剂,在水中强烈水 解。 11.15 什么叫多卤化物?与 I3- 离子比较,形成 Br3- 、Cl3- 离子的趋势怎样? 解: 卤化物与卤素单质或卤素互化物加合所生成的化合物称为多卤化物。与 I3- 离子比较,形成 Br3- 、Cl3- 趋势逐渐减弱. 11.16 什么是卤素互化物? ( a )写出 ClF3 、BrF3 和 IF7 等卤素互化物中心原子杂化轨道,分子电子构型和分子构型

(b)下列化合物与BF;,接触时存在爆炸危险吗?说明原因。 SbEs CHOH :E:SCh. (©)为什么卤素互化物常是反磁性共价型而且比卤素化学活性大? 解:(a))不同卤素原子之间以共价健结合形成的化合物称为卤素互化物。CF;中心原子©提 供s即d杂化轨道间F成键,分子的电子空间构型是三角双锥,分子构型是T型: Xef6:不规则八面体构型: XeO,:三角锥构型: (b)BF是强氧化剂,如遇还原剂可能会发生反应而爆炸。 SbF,遇BrFf时不会反应。 CH,OH遇BF;时存在操炸危险。 F2遇BF时不存在爆炸危险。 S2C,遇BrF时存在爆炸危险. F,:1以s3杂化轨道同F成键,形成五角双锥空间构型 (©)光电子能请表明卤素互化物。例如混合型二卤素分子X双中的分子轨道能级顺序3 12, 一顺序与同核双原子卤素分子的顺序相同。因而其电子填充情形与X 相似,在XX中没有未成对电子,故显反磁性。 11.17实验室有一卤化钙,易溶于水,试利用浓H,S0,确定此盐的性质和名称。 解:因CaF,难溶于水,故该卤化钙不是CaE, 加浓HSO4于固体CaX中,若制得的HK中因含有碘蒸汽而显紫色并有臭鸡蛋味时,则 是Cal2。 Cal2 H2SO4 CaSO4 +2 HI 8H+H,S0(浓)=42+HS↑+4H0 若制得的HⅨ中含有红棕色液滴和刺激性红棕色气体溴以及SO,气体时,则是CaB2 2HBr+HSO4(浓)=Br2↑+SO2↑+2HC 若制得的HX为无色,且冒酸雾,则是CaCl CaCl2 +H2SO=CaSO+2 HClt 11.18请按下面的实例,将溴、碘单质、卤离子及各种含氧酸的相互转化和转化条件绘成相互 关系图。 +催化剂(MnO2,△ +0H(348K) +KMn04,+H △ 1,Br,金属等 (668K)
( b )下列化合物与 BrF3 ,接触时存在爆炸危险吗?说明原因。 SbF5 ;CH3OH ;F2;S2Cl2, ( c )为什么卤素互化物常是反磁性共价型而且比卤素化学活性大? 解:( a ) 不同卤素原子之间以共价键结合形成的化合物称为卤素互化物。ClF3中心原子 Cl 提 供 sp 3d 2 杂化轨道间 F 成键,分子的电子空间构型是三角双锥,分子构型是 T 型; XeF6 :不规则八面体构型; XeO3 :三角锥构型; ( b ) BrF3是强氧化剂,如遇还原剂可能会发生反应而爆炸。 SbF5 遇 BrF3 时不会反应。 CH3OH 遇 BrF3 时存在爆炸危险。 F2 遇 BrF3 时不存在爆炸危险。 S2Cl2 遇 BrF3时存在爆炸危险. IF7:I 以 sp 3d 3 杂化轨道同 F 成键,形成五角双锥空间构型。 ( c )光电子能谱表明卤素互化物,例如混合型二卤素分子 XX ’中的分子轨道能级顺序 3 σ <1 π<2π ,这一顺序与同核双原子卤素分子的顺序相同,因而其电子填充情形与 X2 相似,在 XX ’中没有未成对电子,故显反磁性。 11.17 实验室有一卤化钙,易溶于水,试利用浓 H2SO4确定此盐的性质和名称。 解: 因 CaF2 难溶于水,故该卤化钙不是 CaF2 。 加浓 H2SO4 于固体 CaX2 中,若制得的 HX 中因含有碘蒸汽而显紫色并有臭鸡蛋味时,则 是 CaI2 。 CaI2 + H2SO4 = CaSO4 + 2 HI↑ 8HI + H2SO4(浓)= 4 I2 +H2S↑ + 4 H2O 若制得的 HX 中含有红棕色液滴和刺激性红棕色气体溴以及 SO2 气体时,则是 CaBr2。 CaBr2+ H2SO4 = CaSO4 + 2 HBr↑ 2 HBr + H2SO4(浓)= Br2↑+SO2↑ + 2H2O 若制得的 HX 为无色,且冒酸雾,则是 CaCl2 . CaCl2 + H2SO4= CaSO4 + 2 HCl↑ 11.18 请按下面的实例,将溴、碘单质、卤离子及各种含氧酸的相互转化和转化条件绘成相互 关系图。 解:
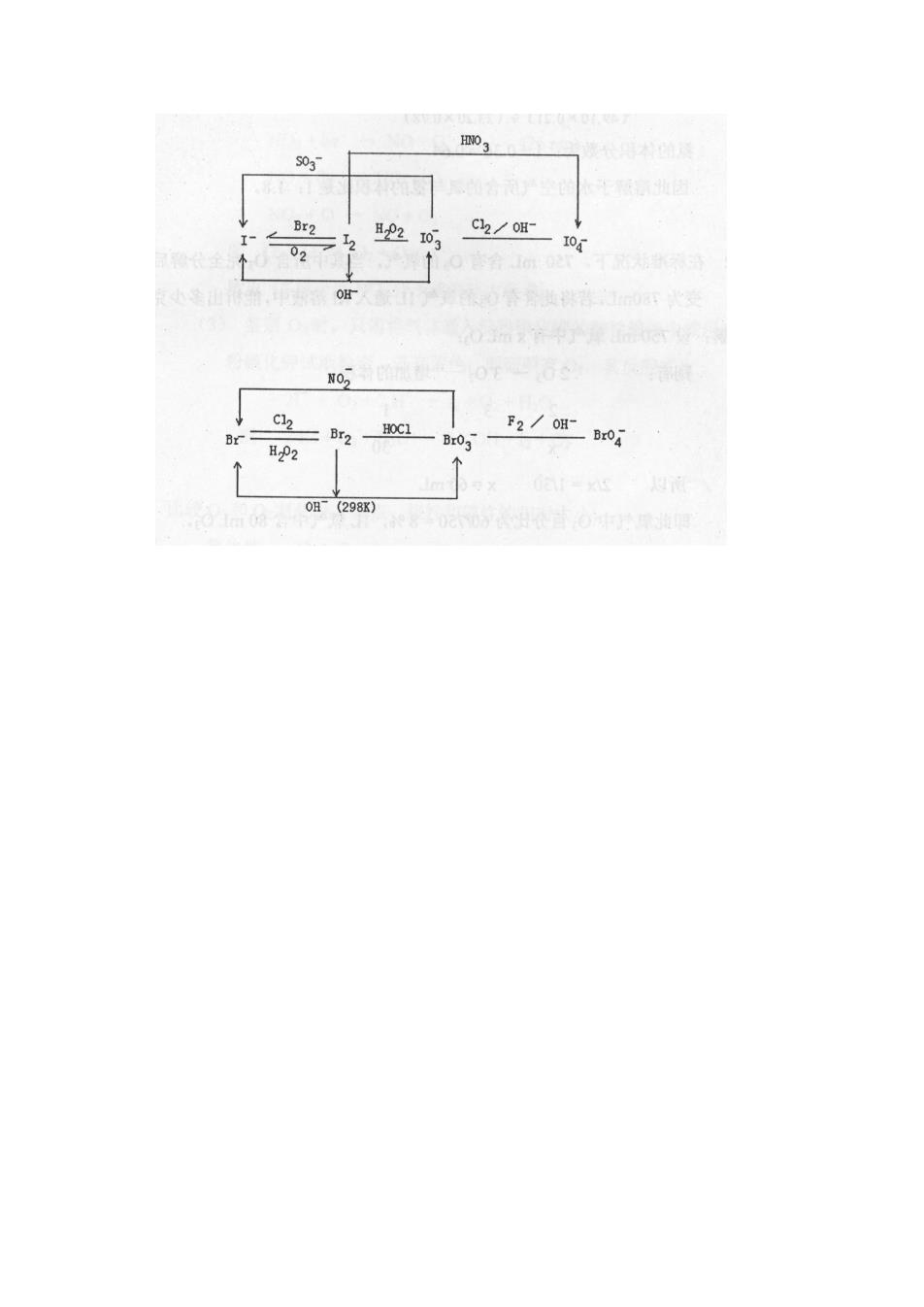
0r2 F2 OH-BrO 98