正在加载图片...
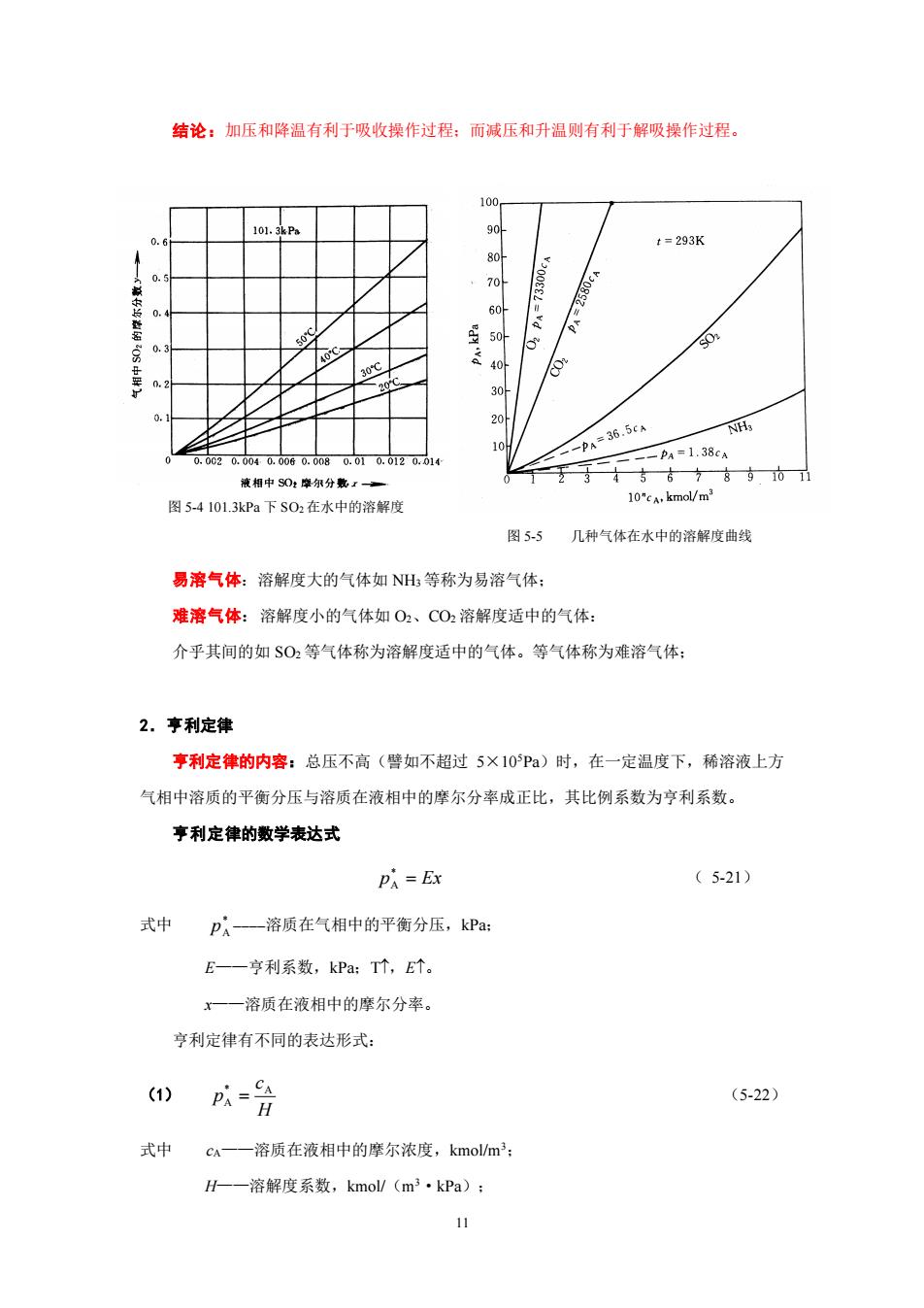
结论:加压和降温有利于吸收操作过程:而减压和升温则有利于解吸操作过程。 100 10 t=293K 20 60 8 30 20A -p36.5cN PA=1.38cA 851 图5-4101.3kPa下S02在水中的溶解度 图5.5 几种气体在水中的溶解度曲戟 易溶气体:溶解度大的气体如NH等称为易溶气体: 难溶气体:溶解度小的气体如02、C02溶解度适中的气体: 介乎其间的如$0,等气体称为溶解度适中的气体。等气体称为难溶气体: 2.亨利定律 享利定律的内容:总压不高(譬如不超过5×10Pa)时,在一定温度下,稀溶液上方 气相中溶质的平衡分压与溶质在液相中的摩尔分率成正比,其比例系数为亨利系数。 亨利定律的数学表达式 PA =Ex (5-21) 式中 pA一溶质在气相中的平衡分压,kP阳 E一一亨利系数,kPa:T个,E个。 x一—溶质在液相中的摩尔分率。 亨利定律有不同的表达形式: (1) p以含 (5-22 式中 c一一溶质在液相中的摩尔浓度,kmol/m H-一溶解度系数,kmol/(m3·kPa):11 图 5-4 101.3kPa 下 SO2在水中的溶解度 图 5-5 几种气体在水中的溶解度曲线 结论:加压和降温有利于吸收操作过程;而减压和升温则有利于解吸操作过程。 易溶气体:溶解度大的气体如 NH3 等称为易溶气体; 难溶气体:溶解度小的气体如 O2、CO2 溶解度适中的气体: 介乎其间的如 SO2 等气体称为溶解度适中的气体。等气体称为难溶气体; 2.亨利定律 亨利定律的内容:总压不高(譬如不超过 5×105Pa)时,在一定温度下,稀溶液上方 气相中溶质的平衡分压与溶质在液相中的摩尔分率成正比,其比例系数为亨利系数。 亨利定律的数学表达式 p = Ex * A ( 5-21) 式中 * A p ————溶质在气相中的平衡分压,kPa; E——亨利系数,kPa;T,E。 x——溶质在液相中的摩尔分率。 亨利定律有不同的表达形式: (1) H c p * A A = (5-22) 式中 cA——溶质在液相中的摩尔浓度,kmol/m3; H——溶解度系数,kmol/(m3·kPa);