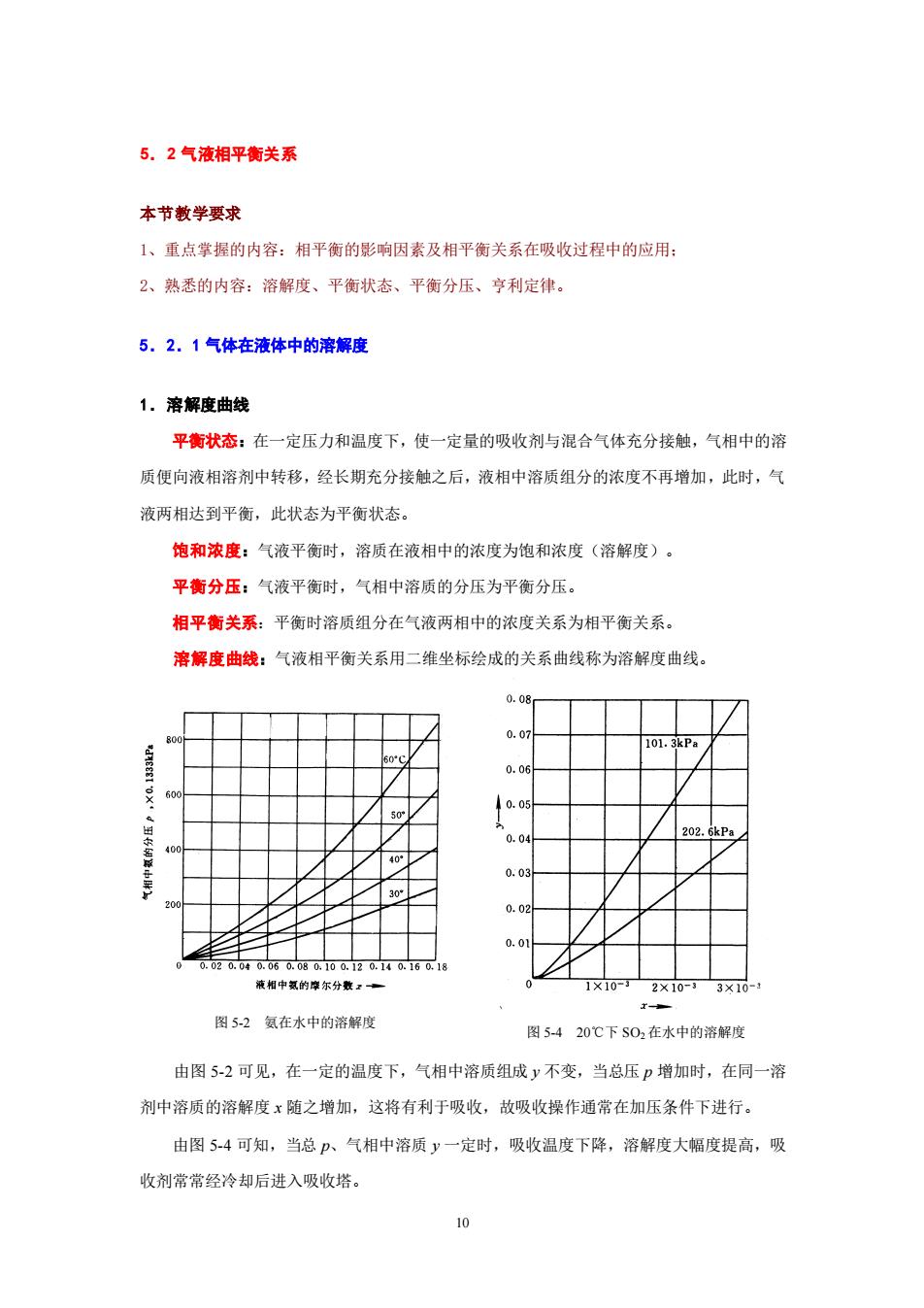
5.2气液相平衡关系 本节教学要求 1、重点掌握的内容:相平衡的影响因素及相平衡关系在吸收过程中的应用: 2、熟悉的内容:溶解度、平衡状态、平衡分压、亨利定律。 5.2.1气体在液体中的溶解度 1.溶解度曲线 平衡状态:在一定压力和温度下,使一定量的吸收剂与混合气体充分接触,气相中的溶 质便向液相溶剂中转移,经长期充分接触之后,液相中溶质组分的浓度不再增加,此时,气 液两相达到平衡,此状态为平衡状态。 饱和浓度:气液平衡时,溶质在液相中的浓度为饱和浓度(溶解度)。 平衡分压:气液平衡时,气相中溶质的分压为平衡分压。 相平衡关系:平衡时溶质组分在气液两相中的浓度关系为相平衡关系。 溶解度曲线:气液相平衡关系用二维坐标绘成的关系曲线称为溶解度曲线。 6kP: 020.0 100.120.10.16018 液相中氨的尔分 1X107 2×10-33×10- 图5-2氨在水中的溶解度 图5-420℃下S02在水中的溶解度 由图5-2可见,在一定的温度下,气相中溶质组成y不变,当总压P增加时,在同一溶 剂中溶质的溶解度x随之增加,这将有利于吸收,故吸收操作通常在加压条件下进行。 由图5-4可知,当总P、气相中溶质y一定时,吸收温度下降,溶解度大幅度提高,吸 收剂常常经冷却后进入吸收塔。 10
10 图 5-2 氨在水中的溶解度 图 5-4 20℃下 SO2在水中的溶解度 5.2 气液相平衡关系 本节教学要求 1、重点掌握的内容:相平衡的影响因素及相平衡关系在吸收过程中的应用; 2、熟悉的内容:溶解度、平衡状态、平衡分压、亨利定律。 5.2.1 气体在液体中的溶解度 1.溶解度曲线 平衡状态:在一定压力和温度下,使一定量的吸收剂与混合气体充分接触,气相中的溶 质便向液相溶剂中转移,经长期充分接触之后,液相中溶质组分的浓度不再增加,此时,气 液两相达到平衡,此状态为平衡状态。 饱和浓度:气液平衡时,溶质在液相中的浓度为饱和浓度(溶解度)。 平衡分压:气液平衡时,气相中溶质的分压为平衡分压。 相平衡关系:平衡时溶质组分在气液两相中的浓度关系为相平衡关系。 溶解度曲线:气液相平衡关系用二维坐标绘成的关系曲线称为溶解度曲线。 由图 5-2 可见,在一定的温度下,气相中溶质组成 y 不变,当总压 p 增加时,在同一溶 剂中溶质的溶解度 x 随之增加,这将有利于吸收,故吸收操作通常在加压条件下进行。 由图 5-4 可知,当总 p、气相中溶质 y 一定时,吸收温度下降,溶解度大幅度提高,吸 收剂常常经冷却后进入吸收塔
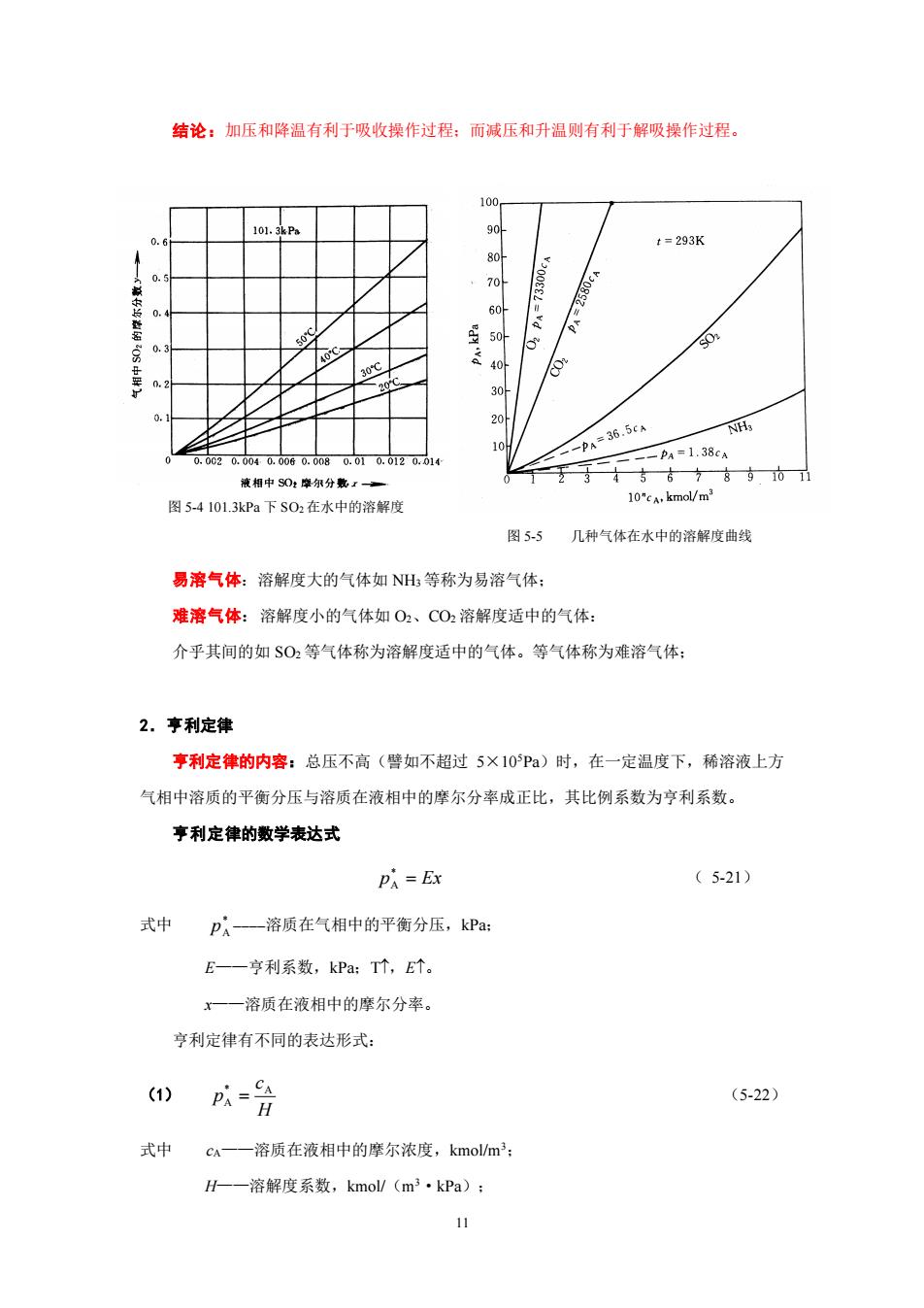
结论:加压和降温有利于吸收操作过程:而减压和升温则有利于解吸操作过程。 100 10 t=293K 20 60 8 30 20A -p36.5cN PA=1.38cA 851 图5-4101.3kPa下S02在水中的溶解度 图5.5 几种气体在水中的溶解度曲戟 易溶气体:溶解度大的气体如NH等称为易溶气体: 难溶气体:溶解度小的气体如02、C02溶解度适中的气体: 介乎其间的如$0,等气体称为溶解度适中的气体。等气体称为难溶气体: 2.亨利定律 享利定律的内容:总压不高(譬如不超过5×10Pa)时,在一定温度下,稀溶液上方 气相中溶质的平衡分压与溶质在液相中的摩尔分率成正比,其比例系数为亨利系数。 亨利定律的数学表达式 PA =Ex (5-21) 式中 pA一溶质在气相中的平衡分压,kP阳 E一一亨利系数,kPa:T个,E个。 x一—溶质在液相中的摩尔分率。 亨利定律有不同的表达形式: (1) p以含 (5-22 式中 c一一溶质在液相中的摩尔浓度,kmol/m H-一溶解度系数,kmol/(m3·kPa):
11 图 5-4 101.3kPa 下 SO2在水中的溶解度 图 5-5 几种气体在水中的溶解度曲线 结论:加压和降温有利于吸收操作过程;而减压和升温则有利于解吸操作过程。 易溶气体:溶解度大的气体如 NH3 等称为易溶气体; 难溶气体:溶解度小的气体如 O2、CO2 溶解度适中的气体: 介乎其间的如 SO2 等气体称为溶解度适中的气体。等气体称为难溶气体; 2.亨利定律 亨利定律的内容:总压不高(譬如不超过 5×105Pa)时,在一定温度下,稀溶液上方 气相中溶质的平衡分压与溶质在液相中的摩尔分率成正比,其比例系数为亨利系数。 亨利定律的数学表达式 p = Ex * A ( 5-21) 式中 * A p ————溶质在气相中的平衡分压,kPa; E——亨利系数,kPa;T,E。 x——溶质在液相中的摩尔分率。 亨利定律有不同的表达形式: (1) H c p * A A = (5-22) 式中 cA——溶质在液相中的摩尔浓度,kmol/m3; H——溶解度系数,kmol/(m3·kPa);

PA一溶质在气相中的平衡分压,kPa。 溶解度系数H与亨利系数E的关系为: 兴 (5-23) 式中Ps一一为溶剂的密度,kgm3。 T个, (2)y=r (5.24 式中x—一液相中溶质的摩尔分率: y'一一与液相组成x相平衡的气相中溶质的摩尔分率: m一一相平衡常数,无因次。 相平衡常数m与亨利系数E的关系为: (5-25 当物系一定时,T或P个,则ml: (3) y'=mX (5-26) 式中X一液相中溶质的摩尔比: Y·一与液相组成X相平衡的气相中溶质的摩尔比: 【例52】某系统温度为10℃,总压1013kPa,试求此条件下在与空气充分接触后的水中, 每立方米水溶解了多少克氧气? 解:空气按理想气体处理,由道尔顿分压定律可知,氧气在气相中的分压为 PA=py=101.3×0.21=21.27kPa 氧气为难溶气体,故氧气在水中的液相组成x很低,气液相平衡关系服从亨利定律,由 表5-1查得10℃时,氧气在水中的亨利系数E为3.31×10kP :H=EM、 0。 C=HPA 12
12 * A p ——溶质在气相中的平衡分压,kPa。 溶解度系数 H 与亨利系数 E 的关系为: S 1 EMS H = (5-23) 式中 S ——为溶剂的密度,kg/m3。 T,H (2) y = mx * (5-24) 式中 x——液相中溶质的摩尔分率; * y ——与液相组成 x 相平衡的气相中溶质的摩尔分率; m——相平衡常数,无因次。 相平衡常数 m 与亨利系数 E 的关系为: p E m = (5-25) 当物系一定时,T或 P,则 m。 (3) Y = mX * (5-26) 式中 X—液相中溶质的摩尔比; * Y —与液相组成 X 相平衡的气相中溶质的摩尔比; 【例 5-2】某系统温度为 10℃,总压 101.3kPa,试求此条件下在与空气充分接触后的水中, 每立方米水溶解了多少克氧气? 解:空气按理想气体处理,由道尔顿分压定律可知,氧气在气相中的分压为: p = py * A =101.3×0.21=21.27kPa 氧气为难溶气体,故氧气在水中的液相组成 x 很低,气液相平衡关系服从亨利定律,由 表 5-1 查得 10℃时,氧气在水中的亨利系数 E 为 3.31×106kPa。 S S EM H = A * cA = Hp

.ci=A EMs 文-写m9-35nxmt mA=3.57×10-×32×1000=11.42g/m 5.2.2相平衡关系在吸收过程中的应用 1.判断过程进行的方向 发生吸收过程的充分必要条件是 y>y或x<x 反之,溶质自液相转移至气相,即发生解吸过程。 2.指明过程进行的极限 塔无限高、溶剂量很小的情况下,无m==上 无限高的塔内,大量的吸收剂和较小气体流量,乃2。==心2: 当x2=0时,2。=0,理论上实现气相溶质的全部吸收。 3。确定过程的推动力 y一y为以气相中溶质摩尔分率差表示吸收过程的推动力: x一x为以液相中溶质的摩尔分率差表示吸收过程的推动力: PA一pA为以气相分压差表示的吸收过程推动力: cA一ca为以液相摩尔 浓度差表示的吸收过程推 动力。 【例5-3】在总压 101.3kPa,温度30C的条 件下,S02摩尔分率为0.3 的混合气体与S02摩尔分 率为0.01的水溶液相接 图57吸收推动力示意图
13 S * S A A EM p c = 故 = = 3.31 10 18 1000 21.27 6 * A c 3.57×10-4kmol/m3 mA=3.57×10-4×32×1000=11.42g/m3 5.2.2 相平衡关系在吸收过程中的应用 1.判断过程进行的方向 发生吸收过程的充分必要条件是 y y *或 x < x * 反之,溶质自液相转移至气相,即发生解吸过程。 2.指明过程进行的极限 塔无限高、溶剂量很小的情况下, m y x x * ,max 1 1 = 1 = ; 无限高的塔内,大量的吸收剂和较小气体流量, 2 * y2,min = y2 = mx ; 当 x2 = 0 时, y2,min = 0 ,理论上实现气相溶质的全部吸收。 3.确定过程的推动力 * y − y 为以气相中溶质摩尔分率差表示吸收过程的推动力; x − x * 为以液相中溶质的摩尔分率差表示吸收过程的推动力; pA-p * A 为以气相分压差表示的吸收过程推动力; c * A-cA为以液相摩尔 浓度差表示的吸收过程推 动力。 【 例 5-3 】在总压 101.3kPa,温度 30℃的条 件下, SO2 摩尔分率为 0.3 的混合气体与 SO2 摩尔分 率为 0.01 的水溶液相接 y2 x2 E y y A P M N x y * O x x * y1 x1 图 5-7 吸收推动力示意图

触,试问: (1)从液相分析SO2的传质方向: (2)从气相分析,其它条件不变,温度降到0℃时S02的传质方向: (3)其它条件不变,从气相分析,总压提高到202.6kPa时S02的传质方向,并计算以 液相摩尔分率差及气相摩尔率差表示的传质推动力。 解:(1)查得在总压101.3kPa,温度30C条件下SO02在水中的亨利系数E-4850Pa 所以 如合智= 从液相分析 4738=0.00627<0.01 x=上= 0.3 故S02必然从液相转移到气相,进行解吸过程。 (2)查得在总压101.3kPa,温度0C的条件下,SO2在水中的亨利系数E=1670kPa m=£-1670=1649 Γp-101.3 从气相分析 y-r-16.49×0.01=0.16y-0.3 故$02必然从气相转移到液相,进行吸收过程。 (3)在总压202.6kPa,温度30C条件下,S02在水中的亨利系数E=4850kPa 台2 从气相分析 y-mr-23.94×0.01=0.24<y-0.3 故SO必然从气相转移到液相,进行吸收过程。 239g=0.0125 x*=上= 0.3 以液相摩尔分数表示的吸收推动力为: △r-x°-=0.0125-0.01=0.0025 以气相摩尔分数表示的吸收推动力为: △yy-y=0.3-0.24=0.06 结论:降低操作温度,E人、m↓,溶质在液相中的溶解度增加,有利于吸收:
14 触,试问: (1) 从液相分析 SO2 的传质方向; (2) 从气相分析,其它条件不变,温度降到 0℃时 SO2 的传质方向; (3) 其它条件不变,从气相分析,总压提高到 202.6kPa 时 SO2 的传质方向,并计算以 液相摩尔分率差及气相摩尔率差表示的传质推动力。 解:(1)查得在总压 101.3kPa,温度 30℃条件下 SO2 在水中的亨利系数 E=4850kPa 所以 = = p E m = 101.3 4850 47.88 从液相分析 0.00627 47.88 * 0.3 = = = m y x < x=0.01 故 SO2 必然从液相转移到气相,进行解吸过程。 (2)查得在总压 101.3kPa,温度 0℃的条件下,SO2 在水中的亨利系数 E=1670kPa = = p E m 101.3 1670 =16.49 从气相分析 y *=mx=16.49×0.01=0.16<y=0.3 故 SO2 必然从气相转移到液相,进行吸收过程。 (3)在总压 202.6kPa,温度 30℃条件下,SO2 在水中的亨利系数 E=4850kPa = = p E m 202.6 4850 =23.94 从气相分析 y *=mx=23.94×0.01=0.24<y=0.3 故 SO2 必然从气相转移到液相,进行吸收过程。 0.0125 23.94 0.3 * = = = m y x 以液相摩尔分数表示的吸收推动力为: ∆x=x*-x=0.0125-0.01=0.0025 以气相摩尔分数表示的吸收推动力为: ∆y= y - y *=0.3-0.24=0.06 结论:降低操作温度,E、m,溶质在液相中的溶解度增加,有利于吸收;

压力不太高时,PT,E变化忽略不计:但m↑使溶质在液相中的溶解度增加,有 利于吸收
15 压力不太高时,P, E 变化忽略不计;但 m使溶质在液相中的溶解度增加,有 利于吸收