
6.2双组分溶液的气液相平衡 1、掌握的内容一一双组分理想物系的汽液平衡,拉乌尔定律、泡点方程、露点方程、 汽液相平衡图、挥发度与相对挥发度定义及应用、相平衡方程及应用: 2、了解的内容 一一非理想物系汽液平衡 3、本节难点一 t-x-y图及y-x图,相对挥发度的特点。 6.2.1理想溶液的气液相平衡 汽液相平衡,是指溶液与其上方蒸汽达到平衡时气液两相间各组分组成的关系。 理想溶液的汽液相平衡服从拉乌尔(Raou)定律 因此对含有A、B组分的理想溶液可以得出: Pa=PI'x (6-1a) PR-PRXR=PR C-4) (6-1b) 式中:PaPB 溶液上方A和B两组分的平衡分压,Pa: 同温度下,纯组分A和B的饱和蒸汽压,P阳 XAXB 混合液组分A和B的摩尔分率, 理想物系气相服从道尔顺分压定律,既总压等于各组分分压之和 对双组分物系: P-PA+P8 (6-2) 式中 气相总压,Pa: PA和PB 4,B组分在气相的分压,Pa 根据拉乌尔定律和道尔顿分压定律,可得泡点方程: X4= P-Pa (6-4) P-P 式(64)称为池点方程,该方程描述平衡物系的温度与液相组成的关系。 可得露点方程式: y=Prp-pr 6-5 pP°-Pa 式(65)称为露点方程式,该方程描述平衡物系的温度与气相组成的关系 在总压一定的条件下,对于理想溶液,只要溶液的饱和温度已知,根据AB组分的蒸 气压数据,查出饱和蒸汽压P°,P”,则可以采用式(6-4)的泡点方程确定液相组成x,采 用式(6-5)的露点方程确定与液相呈平衡的气相组成y。 6.2.2温度组成图(-x图) 1
1 6.2 双组分溶液的气液相平衡 1、掌握的内容——双组分理想物系的汽液平衡,拉乌尔定律、泡点方程、露点方程、 汽液相平衡图、挥发度与相对挥发度定义及应用、相平衡方程及应用; 2、了解的内容——非理想物系汽液平衡; 3、本节难点——t-x-y 图及 y-x 图,相对挥发度的特点。 6.2.1 理想溶液的气液相平衡 汽液相平衡,是指溶液与其上方蒸汽达到平衡时气液两相间各组分组成的关系。 理想溶液的汽液相平衡服从拉乌尔(Raoult)定律。 因此对含有 A、B 组分的理想溶液可以得出: PA=PA o xA (6-1a) PB=PB o xB= PB o(1-xA) (6-1b) 式中: PA, PB —— 溶液上方 A 和 B 两组分的平衡分压,Pa; PA o ,PB o —— 同温度下,纯组分 A 和 B 的饱和蒸汽压,Pa; xA ,xB —— 混合液组分 A 和 B 的摩尔分率。 理想物系气相服从道尔顿分压定律,既总压等于各组分分压之和。 对双组分物系: P=PA+PB (6-2) 式中: P—— 气相总压,Pa ; PA 和 PB —— A,B 组分在气相的分压,Pa。 根据拉乌尔定律和道尔顿分压定律,可得泡点方程: o A o B A P P p p x − − = (6-4) 式(6-4)称为泡点方程,该方程描述平衡物系的温度与液相组成的关系。 可得露点方程式: o B o A o B o A A p p p p p p y − − = 6-5 式(6-5)称为露点方程式,该方程描述平衡物系的温度与气相组成的关系。 在总压一定的条件下,对于理想溶液,只要溶液的饱和温度已知,根据 A,B 组分的蒸 气压数据,查出饱和蒸汽压 PA 0 , PB 0 , 则可以采用式(6-4)的泡点方程确定液相组成 xA,采 用式(6-5)的露点方程确定与液相呈平衡的气相组成 yA。 6.2.2 温度组成图(t-y-x 图)
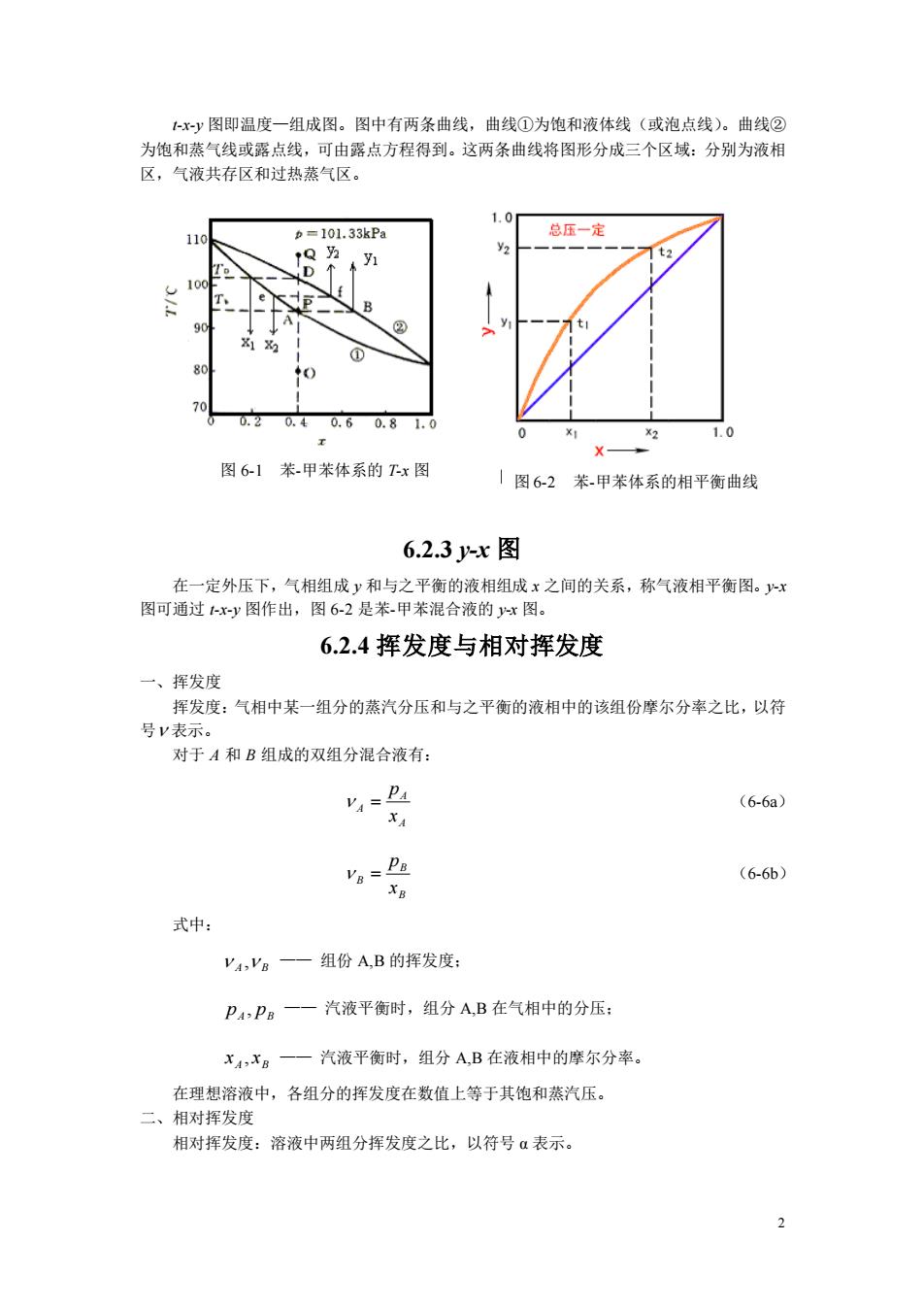
y图即温度一组成图。图中有两条曲线,曲线①为饱和液体线(或泡点线)。曲线② 为饱和蒸气线或露点线,可由露点方程得到。这两条曲线将图形分成三个区域:分别为液相 区,气液共存区和过热蒸气区。 1.0 b=101.33kPa 总压一定 0.20. 0.60.81.0 10 图61苯.甲苯体系的Tx图 |图6-2苯甲苯体系的相平衡曲线 6.2.3x图 在一定外压下,气相组成y和与之平衡的液相组成x之间的关系,称气液相平衡图。x 图可通过xy图作出,图6-2是苯.甲苯混合液的x图。 6.2.4挥发度与相对挥发度 一、挥发度 挥发度:气相中某一组分的蒸汽分压和与之平衡的液相中的该组份摩尔分率之比,以符 号V表示。 对于A和B组成的双组分混合液有: (6-6a) XA Va=Pa (6-60) 式中: V,Vg一—组份AB的挥发度: Pa,PB一一汽液平衡时,组分AB在气相中的分压: XA-X8 一汽液平衡时,组分A,B在液相中的摩尔分率。 在理想溶液中,各组分的挥发度在数值上等于其饱和蒸汽压。 二、相对挥发度 相对挥发度:溶液中两组分挥发度之比,以符号α表示
2 t-x-y 图即温度—组成图。图中有两条曲线,曲线①为饱和液体线(或泡点线)。曲线② 为饱和蒸气线或露点线,可由露点方程得到。这两条曲线将图形分成三个区域:分别为液相 区,气液共存区和过热蒸气区。 6.2.3 y-x 图 在一定外压下,气相组成 y 和与之平衡的液相组成 x 之间的关系,称气液相平衡图。y-x 图可通过 t-x-y 图作出,图 6-2 是苯-甲苯混合液的 y-x 图。 6.2.4 挥发度与相对挥发度 一、挥发度 挥发度:气相中某一组分的蒸汽分压和与之平衡的液相中的该组份摩尔分率之比,以符 号 表示。 对于 A 和 B 组成的双组分混合液有: A A A x p = (6-6a) B B B x p = (6-6b) 式中: A B , —— 组份 A,B 的挥发度; pA pB , —— 汽液平衡时,组分 A,B 在气相中的分压; A B x , x —— 汽液平衡时,组分 A,B 在液相中的摩尔分率。 在理想溶液中,各组分的挥发度在数值上等于其饱和蒸汽压。 二、相对挥发度 相对挥发度:溶液中两组分挥发度之比,以符号 α 表示。 图 6-1 苯-甲苯体系的 T-x 图 图 6-2 苯-甲苯体系的相平衡曲线

a=业= (6-8) Va Pa 或写成: y-a (69) VB X 相对挥发度α值的大小,表示气相中两组分的浓度比是液相中浓度比的倍数。所以。 值可作为混合物采用蒸馏法分离的难易标志,若α大于1,y>x,说明该溶液可以用蒸馏方法 来分离,α越大,A组分越易分离:若a=1,则说明混合物的气相组分与液相组分相等:则普 通蒸馏方式将无法分离此混合物:1。 对于二元混合物,当总压不高时,可得相平衡方程: y=1+(a-0x (6-10) 对于理想溶液,因其服从拉乌尔定律,故有: a='= (6-11) Va Poo 即理想溶液的相对挥发度等于同温度下两纯组分的饱和蒸汽压之比。 三、平均相对挥发度am 对于精馏塔,由于每块塔上xy组成不同,温度不同,α也会有所变化,因此对于整个 精馏塔 一般采用相对挥发度的平均值,即平均相对挥发度来表示,以符号a表示。即: an=√口须×a生 (6-13) 式中:α一塔顶的相对挥发度: α一一塔釜的相对挥发度。 6.2.5非理想溶液的汽液相平衡 在工业生产中,理想溶液很少,原因在于同种分子间的作用力与异种分子间的作用力不 同,因偏差有正有负,故将溶液分为对拉乌尔定律具有正偏差的溶液和具有负偏差的溶液。 一、具有正偏差的溶液 100下 p=101.33kPa 1.0p=1o1.3kP 85 0. 80 M A 75 1.0 0.20.40.60.8 (a)T-x-y (b)x-y 图6一3乙醇水溶液的相图
3 B B A A B A x p x p = = (6-8) 或写成: B A B A x x y y = (6-9) 相对挥发度 α 值的大小,表示气相中两组分的浓度比是液相中浓度比的倍数。所以 α 值可作为混合物采用蒸馏法分离的难易标志, 若 α 大于 1, y>x,说明该溶液可以用蒸馏方法 来分离, α 越大, A 组分越易分离;若 α=1,则说明混合物的气相组分与液相组分相等;则普 通蒸馏方式将无法分离此混合物;α1。 对于二元混合物,当总压不高时,可得相平衡方程: x x y 1+ ( −1) = (6-10) 对于理想溶液,因其服从拉乌尔定律,故有: 0 0 B A B P P = = A (6-11) 即理想溶液的相对挥发度等于同温度下两纯组分的饱和蒸汽压之比。 三、平均相对挥发度 αm 对于精馏塔,由于每块塔上 x,y 组成不同,温度不同,α 也会有所变化,因此对于整个 精馏塔,一般采用相对挥发度的平均值,即平均相对挥发度来表示,以符号 αm表示。即: m = 顶 釜 (6-13) 式中:α 顶——:塔顶的相对挥发度; α 釜——塔釜的相对挥发度。 6.2.5 非理想溶液的汽液相平衡 在工业生产中,理想溶液很少,原因在于同种分子间的作用力与异种分子间的作用力不 同,因偏差有正有负,故将溶液分为对拉乌尔定律具有正偏差的溶液和具有负偏差的溶液。 一、具有正偏差的溶液 图 6-3 乙醇水溶液的相图
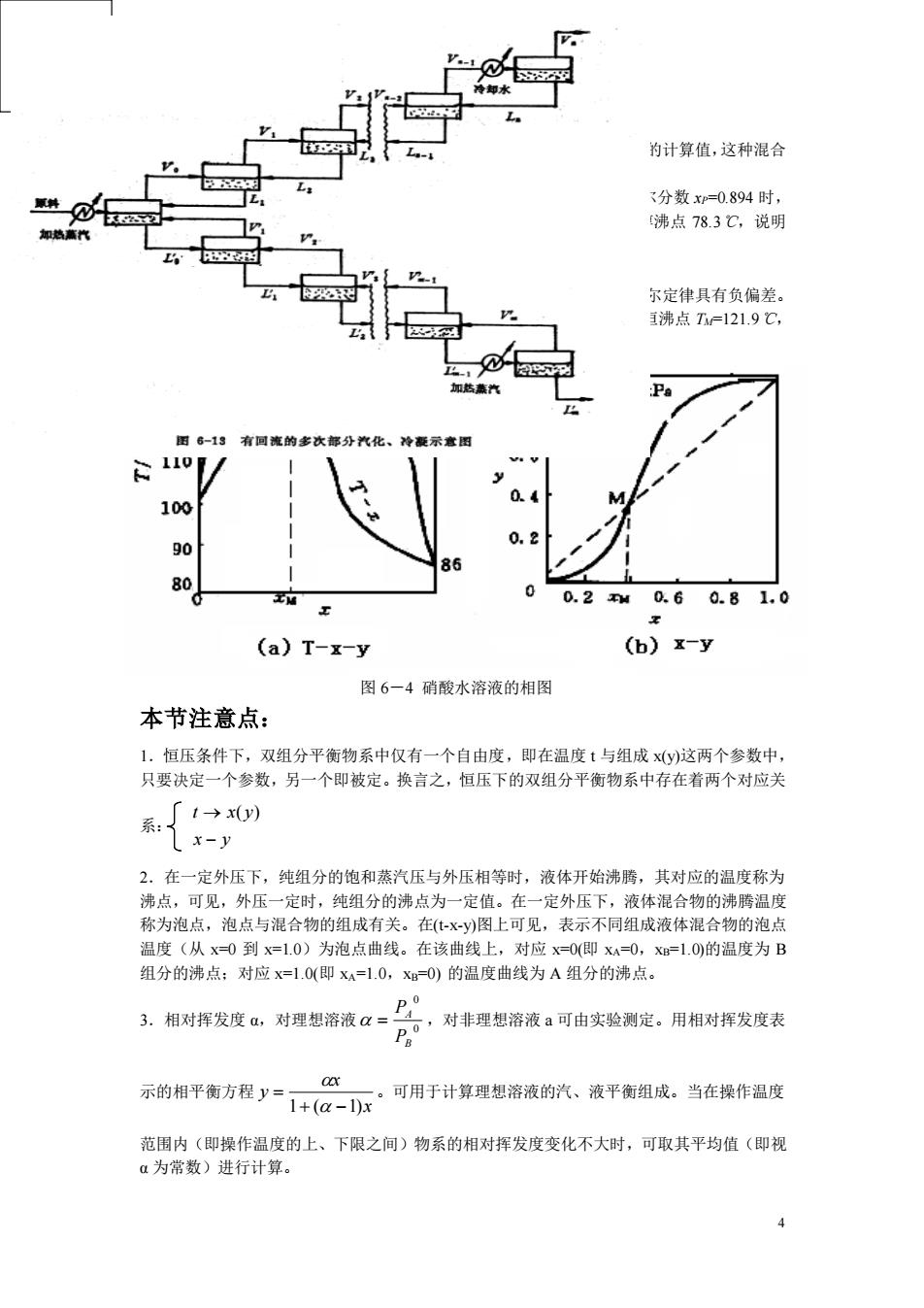
为计算值,这种混合 分数=0.894时, 沸点78.3℃,说明 尔定律具有负偏差 沸点T=121.9C Pa 90 0.20.60.81.0 (a)T-x-y (b)x-y 图6一4硝酸水溶液的相图 本节注意点: 1,恒压条件下,双组分平衡物系中仅有一个自由度,即在温度t与组成xy)这两个参数中, 只要决定一个参数,另一个即被定。换言之,恒压下的双组分平衡物系中存在着两个对应关 2.在一定外压下,纯组分的饱和蒸汽压与外压相等时,液体开始沸瞒,其对应的温度称为 沸点,可见,外压一定时,纯组分的沸点为一定值。在一定外压下,液体混合物的沸腾温度 称为泡点,泡点与混合物的组成有关。在Xy)图上可见,表示不同组成液体混合物的泡点 温度(从x0到x=10)为泡点曲线。在该曲线上, 对应X=0(即X司 1.0的温度为B 组分的沸点:对应x=1.0(即XA=1.0,=O)的温度曲线为A组分的沸点。 3。相对挥发度0,对理想溶液口= 。,对非理想溶液a可由实验测定。用相对挥发度表 示的相平衡方程y=1+a-1x 可用于计算理想溶液的汽、液平衡组成。当在操作温度 范围内(即操作温度的上、下限之间)物系的相对挥发度变化不大时,可取其平均值(即视 a为常数)进行计算。 4
4 当在相同温度下溶液上方各组分的蒸汽分压均大于采用拉乌尔定律的计算值,这种混合 液对拉乌尔定律具有正偏差。 以图 6-3 乙醇-水溶液的汽液相平衡图为例。在总压 1atm,乙醇的摩尔分数 xP=0.894 时, 所对应的温度为 78.15℃,称为最低恒沸点,而水的沸点为 100℃,乙醇沸点 78.3℃,说明 具有该点组成的混合物为恒沸物。 二、具有负偏差的溶液 当各组分的蒸汽分压小于拉乌尔定律的计算时,这种混合液对拉乌尔定律具有负偏差。 如图 6-4 硝酸-水溶液,在总压 1atm 下,恒沸组成 xM=0.383,最高恒沸点 TM=121.9℃, 比水的沸点(100℃)与纯硝酸的沸点(86℃)都高。 本节注意点: 1.恒压条件下,双组分平衡物系中仅有一个自由度,即在温度 t 与组成 x(y)这两个参数中, 只要决定一个参数,另一个即被定。换言之,恒压下的双组分平衡物系中存在着两个对应关 系: x y t x y − → ( ) 2.在一定外压下,纯组分的饱和蒸汽压与外压相等时,液体开始沸腾,其对应的温度称为 沸点,可见,外压一定时,纯组分的沸点为一定值。在一定外压下,液体混合物的沸腾温度 称为泡点,泡点与混合物的组成有关。在(t-x-y)图上可见,表示不同组成液体混合物的泡点 温度(从 x=0 到 x=1.0)为泡点曲线。在该曲线上,对应 x=0(即 xA=0,xB=1.0)的温度为 B 组分的沸点;对应 x=1.0(即 xA=1.0,xB=0) 的温度曲线为 A 组分的沸点。 3.相对挥发度 α,对理想溶液 0 0 B A P P = ,对非理想溶液 a 可由实验测定。用相对挥发度表 示的相平衡方程 x x y 1+ ( −1) = 。可用于计算理想溶液的汽、液平衡组成。当在操作温度 范围内(即操作温度的上、下限之间)物系的相对挥发度变化不大时,可取其平均值(即视 α 为常数)进行计算。 图 6-4 硝酸水溶液的相图