正在加载图片...
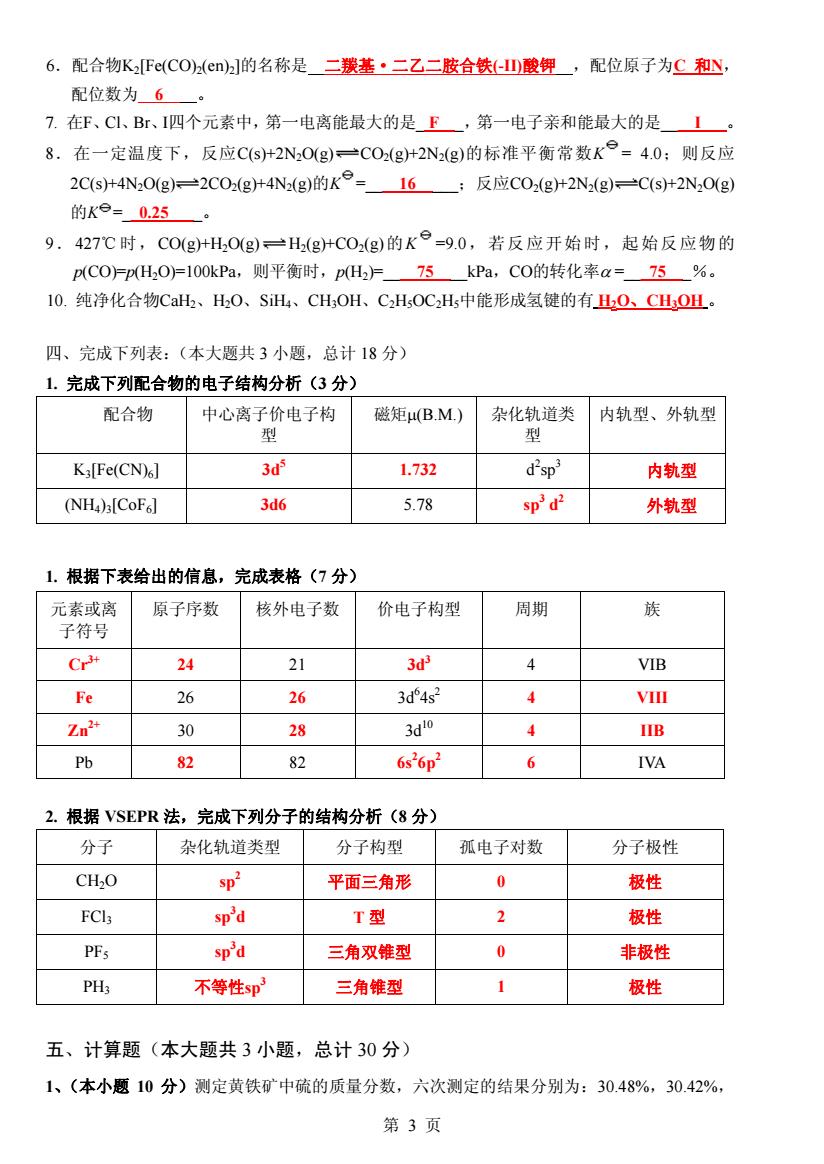
6.配合物KFc(COa(en]的名称是二羰基·二乙二胺合铁山酸钾,配位原子为C和y 配位数为6 7.在F、C1、Br、I四个元素中,第一电离能最大的是F,第一电子亲和能最大的是1 8.在一定温度下,反应C(S+2N,O(g)一COg+2N2(g)的标准平衡常数K°=4.0:则反应 2C(s+4N2Og)=2C0(g+4N(g)的K°-=16;反应C02(g+2N2(g)一C(S+2N,0(g) 的Ke=0.25 9.427℃时,C0(g+H,0g)H(g+C0(g)的K=9.0,若反应开始时,起始反应物的 p(CO)=P(H,OF100kPa,则平衡时,pH2F75_kPa,CO的转化率a=75_%。 10.纯净化合物CaH、H,O、SiHL、CH,OH、CH,OC2H5中能形成氢键的有O、CHOL.。 四、完成下列表:(本大题共3小题,总计18分) 1.完成下列配合物的电子结构分析(3分) 配合物 中心离子价电子构 磁矩μ(B.M) 杂化轨道类 内轨型、外轨型 型 型 Ka[Fe(CN)6] 3 1.732 d'sp 内轨型 (NH)[CoFal 3d6 5.78 sp'd2 外轨型 1.根据下表给出的信息,完成表格(7分) 元素或离 原子序数 核外电子数 价电子构型 周期 族 子符号 Cr 24 21 3 4 VIB Fe 26 26 3d4s2 4 VIll Zn 30 28 3d0 4 IIB Pb 82 82 6s26p2 6 IVA 2.根据VSEPR法,完成下列分子的结构分析(8分) 分子 杂化轨道类型 分子构型 孤电子对数 分子极性 CH2O sp2 平面三角形 0 极性 FCl3 sp'd T型 2 极性 PFs sp'd 三角双锥型 0 非极性 PH3 不等性sp 三角维型 1 极性 五、计算题(本大题共3小题,总计30分) 1、(本小题10分)测定黄铁矿中硫的质量分数,六次测定的结果分别为:30.48%,30.42% 第3页 6.配合物K2[Fe(CO)2(en)2]的名称是 二羰基·二乙二胺合铁(-II)酸钾 ,配位原子为C 和N, 配位数为 6 。 7. 在F、Cl、Br、I四个元素中,第一电离能最大的是_ F _,第一电子亲和能最大的是____I___。 8.在一定温度下,反应C(s)+2N2O(g) CO2(g)+2N2(g)的标准平衡常数K = 4.0;则反应 2C(s)+4N2O(g) 2CO2(g)+4N2(g)的K =____16_____;反应CO2(g)+2N2(g) C(s)+2N2O(g) 的K =__0.25____。 9.427℃时,CO(g)+H2O(g) H2(g)+CO2(g)的K =9.0,若反应开始时,起始反应物的 p(CO)=p(H2O)=100kPa,则平衡时,p(H2)=____75____kPa,CO的转化率α =___75___%。 10. 纯净化合物CaH2、H2O、SiH4、CH3OH、C2H5OC2H5中能形成氢键的有 H2O、CH3OH 。 四、完成下列表:(本大题共 3 小题,总计 18 分) 1. 完成下列配合物的电子结构分析(3 分) 配合物 中心离子价电子构 型 磁矩μ(B.M.) 杂化轨道类 型 内轨型、外轨型 K3[Fe(CN)6] 3d5 1.732 d2 sp 3 内轨型 (NH4)3[CoF6] 3d6 5.78 sp3 d2 外轨型 1. 根据下表给出的信息,完成表格(7 分) 元素或离 子符号 原子序数 核外电子数 价电子构型 周期 族 Cr3+ 24 21 3d3 4 VIB Fe 26 26 3d6 4s2 4 VIII Zn2+ 30 28 3d10 4 IIB Pb 82 82 6s2 6p2 6 IVA 2. 根据 VSEPR 法,完成下列分子的结构分析(8 分) 分子 杂化轨道类型 分子构型 孤电子对数 分子极性 CH2O sp 2 平面三角形 0 极性 FCl3 sp3 d T 型 2 极性 PF5 sp3 d 三角双锥型 0 非极性 PH3 不等性sp3 三角锥型 1 极性 五、计算题(本大题共 3 小题,总计 30 分) 1、(本小题 10 分)测定黄铁矿中硫的质量分数,六次测定的结果分别为:30.48%,30.42%, 第 3 页